Нуртек (Nurtec) инструкция по применению
- 📜 Инструкция по применению Нуртек
- 💊 Состав препарата Нуртек
- ✅ Применение препарата Нуртек
- 📅 Условия хранения Нуртек
- ⏳ Срок годности Нуртек
Владелец регистрационного удостоверения:
Лекарственная форма
|
|
Нуртек |
Таблетки, диспергируемые в полости рта, 75 мг: 2, 8 или 16 шт.
рег. №: ЛП-(008633)-(ГП-RU)
от 29.04.25
- Действующее
|
Форма выпуска, упаковка и состав препарата Нуртек
Таблетки, диспергируемые в полости рта, белые или почти белые, круглые, лиофилизированные, с маркировкой (тиснением) " ".
".
| 1 таб. | |
| римегепанта сульфат | 85.65 мг, |
| в пересчете на римегепант | 75 мг |
Вспомогательные вещества: желатин (рыбий с высокомолекулярной массой (Fish HMW)), маннитол, сукралоза микронизированная, ароматизатор Мята 51.296.
2 шт. - блистеры (1) - пачки картонные.
8 шт. - блистеры (1) - пачки картонные.
8 шт. - блистеры (2) - пачки картонные.
Допускается наличие контроля первого вскрытия.
Фармакологическое действие
Механизм действия
Римегепант избирательно связывается с высоким сродством с рецептором человеческого кальцитонин-ген-связанного пептида (Calcitonin gene-related peptide - CGRP) и является антагонистом этого рецептора.
Связь между фармакодинамическим действием и механизмами, с помощью которых римегепант оказывает свои клинические эффекты, неизвестна.
Клиническая эффективность: купирование приступа мигрени
Эффективность препарата Нуртек при купировании приступа мигрени с аурой и без нее у взрослых изучалась в трех рандомизированных двойных слепых плацебо-контролируемых исследованиях (исследования 1-3). Пациентам дали указания принимать препарат в случае мигренозной боли умеренной или сильной интенсивности. Резервные лекарственные препараты (т. е. НПВП), парацетамол и/или противорвотные препараты) разрешалось применять через 2 ч после начала лечения. Применять другие резервные лекарственные препараты, такие как триптаны, не разрешалось в течение 48 ч после начала лечения. На исходном уровне приблизительно 14% пациентов принимали профилактические лекарственные препараты для лечения мигрени. Ни один из пациентов в исследовании 1 не принимал одновременно профилактические лекарственные препараты, воздействующие на CGRP.
Первичный анализ эффективности проводился у пациентов с мигренозной болью умеренной или сильной интенсивности. Под избавлением от боли считалось полное устранение головной боли умеренной или сильной интенсивности, а под избавлением от наиболее неприятного симптома считалось отсутствие симптома, который пациент считал самым неприятным (т.е. фотофобии, фонофобии или тошноты). Среди пациентов, озвучивших наиболее неприятный симптом, таким самым распространенным симптомом была фотофобия (54%), следующими по распространенности были тошнота (28%) и фонофобия (15%).
В исследовании 1 процентная доля пациентов, которым удалось избавиться от головной боли и наиболее неприятного симптома в течение 2 ч после приема одной дозы, была статистически значимо выше в группе пациентов, принимавших препарат Нуртек, по сравнению с группой пациентов, принимавших плацебо (таблица 1). Кроме того, статистически значимые эффекты препарата Нуртек по сравнению с плацебо были продемонстрированы и в отношении дополнительных конечных точек оценки эффективности: облегчение боли в течение 2 ч, продолжительное отсутствие боли в течение 2-48 ч, применение резервных препаратов в течение 24 ч и способность нормально функционировать через 2 ч после приема препарата. Облегчением боли считалось как уменьшение умеренной или сильной интенсивности мигренозной боли до легкой интенсивности, так и полное устранение боли. Опорные двойные слепые плацебо-контролируемые исследования однократного приступа: исследования 2 и 3 проводились с участием пациентов с мигренью, которые получили одну лекарственную форму биоэквивалентную 75 мг римегепанта.
Таблица 1. Конечные точки оценки эффективности в исследованиях купировання приступов мигрени
| Исследование 1 | Исследование 2 | Исследование 3 | ||||
| Римегепант 75 мг | Плацебо | Римегепант 75 мг | Плацебо | Римегепант 75 мг | Плацебо | |
| Избавление от боли за 2 часа | ||||||
| n/N* | 142/669 | 74/682 | 105/537 | 64/535 | 104/543 | 77/541 |
| % пациентов с ответом на лечение | 21.2 | 10.9 | 19.6 | 12.0 | 19.2 | 14.2 |
| Различие по сравнению с плацебо (%) | 10.3 | 7.6 | 4.9 | |||
| p-значение | <0.0001a | <0.0006a | <0.0298a | |||
| Избавление от ННС за 2 часа | ||||||
| n/N* | 235/669 | 183/682 | 202/537 | 135/535 | 199/543 | 150/541 |
| % пациентов с ответом на лечение | 35.1 | 26.8 | 37.6 | 25.2 | 36.6 | 27.7 |
| Различие по сравнению с плацебо (%) | 8.3 | 12.4 | 8.9 | |||
| p-значение | <0.0009a | <0.0001a | <0.0016a | |||
| Облегчение боли за 2 часа | ||||||
| n/N* | 397/669 | 295/682 | 312/537 | 229/535 | 304/543 | 247/541 |
| % пациентов с ответом на лечение | 59.3 . | 43.3 | 58.1 | 42.8 | 56.0 | 45.7 |
| Различие по сравнению с плацебо (%) | 16.1 | 15.3 | 10.3 | |||
| p-значение | <0.0001a | <0.0001a | <0.0006a | |||
| Продолжительное отсутствие боли в течение 2-48 часов | ||||||
| n/N* | 90/669 | 37/682 | 53/537 | 32/535 | 63/543 | 39/541 |
| % пациентов с ответом на лечение | 13.5 | 5.4 | 9.9 | 6.0 | 11.6 | 7.2 |
| Различие по сравнению с плацебо (%) | 8.0 | 3.9 | 4.4 | |||
| p-значение | <0.0001a | <0.0181б | <0.0130б | |||
*n - количество пациентов с ответом на лечение/N - число пациентов в этой группе терапии.
a Значимое р-значение в многоуровневой процедуре тестирования.
б Номинальное р-значение в многоуровневой процедуре тестирования.
ННС - наиболее неприятный симптом
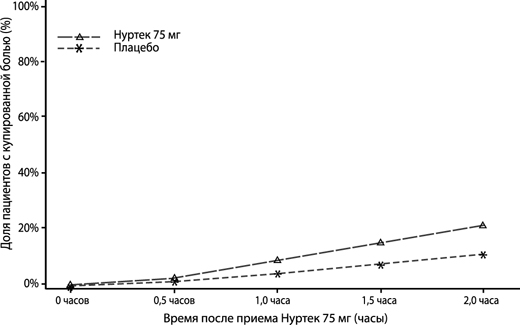
На рисунке 1 представлена доля пациентов в процентах, у которых приступ мигрени был купирован в течение 2 часов после приема препарата в исследовании 1.
Рисунок 1. Доля пациентов в процентах, у которых приступ мигрени был купирован·в течение 2 часов в исследовании 1
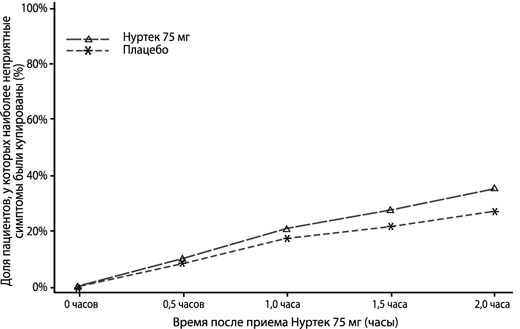
На рисунке 2 представлена доля пациентов в процентах, у которых наиболее неприятные симптомы были купированы в течение 2 часов в исследовании 1.
Рисунок 2. Доля пациентов в процентах, у которых наиболее неприятные симптомы были купированы·в течение 2 часов в исследовании 1
Во всех 3 исследованиях частота возникновения фотофобии и фонофобии снижалась в течение 2 часов после приема препарата Нуртек в дозе 75 мг в сравнении с плацебо.
Клиническая эффективность: при профилактике
Эффективность римегепанта при профилактическом лечении мигрени оценивалась в рандомизированном двойном слепом плацебо-контролируемом исследовании (исследование 4).
Исследование 4 включало взрослых мужчин и женщин, страдающих мигренью в течение минимум 1 года (с аурой или без нее). У пациентов в анамнезе была мигренозная ·боль умеренной или сильной интенсивности, возникавшая с частотой 4-18 приступов за 4-недельный период в пределах 12 недель до скринингового визита. Среднее количество дней, в которые у пациентов возникала головная боль, составило 10.9 дня за 28-дневный период наблюдения, включая в среднем 10.2 дня мигрени, до рандомизации в рамках исследования. В исследовании пациентам посредством рандомизации назначался прием римегепанта в дозе 75 мг (N = 373) или плацебо (N = 374) в течение периода до 12 недель. Пациентам дали указания принимать назначенный препарат 1 раз через день в течение 12-недельноrо периода лечения. При необходимости пациентам разрешалось применять другие препараты, использующиеся для купирования приступов мигрени (например, триптаны, НПВП, парацетамол, противорвотные препараты). На исходном уровне приблизительно 22% пациентов принимали профилактические лекарственные препараты для лечения мигрени. Пациентам разрешалось продолжить участие в открытом расширенном исследовании в течение дополнительных 12 месяцев.
Первичной конечной точкой оценки эффективности в исследовании 4 было изменение среднего количества дней мигрени в месяц относительно исходного уровня по итогам недель 9-12 приема препарата в двойной слепой фазе. Вторичные конечные точки, включали уменьшение, как минимум на 50% количества дней мигрени умеренной или сильной интенсивности в месяц относительно исходного уровня.
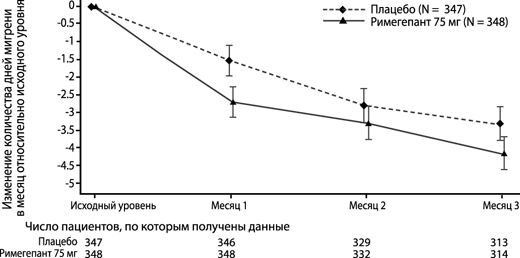
Римегепант при приеме в дозе 75 мг через день продемонстрировал статистически значимое улучшение в отношении ключевых конечных точек оценки эффективности по сравнению с плацебо, как показано в таблице 2 и на рисунке 3.
Таблица 2. Ключевые конечные точки оценки эффективности в исследовании 4
| Римегепапт 75 мг через день | Плацебо | |
| Количество дней мигрени в месяц по итогам недель 9-12 | N=348 | N=347 |
| Изменение относительно исходного уровня | -4.3 | -3.5 |
| Изменение по сравнению с плацебо | -0.8 | |
| p-значение | 0,010а | |
| Уменьшение, как минимум на 50%, количества дней мигрени умеренной или сильной интенсивности в месяц по итогам 9-12 недель | N=348 | N=347 |
| % пациентов с ответом | 49.1 | 41.5 |
| Различие по сравнению с плацебо | 7.6 | |
| p-значение | 0.044а |
а Значимое р-значение в многоуровневой процедуре тестирования
Рисунок 3. Изменение количества дней мигрени в месяц относительно исходного уровня в исследовании 4
Долгосрочная эффективность
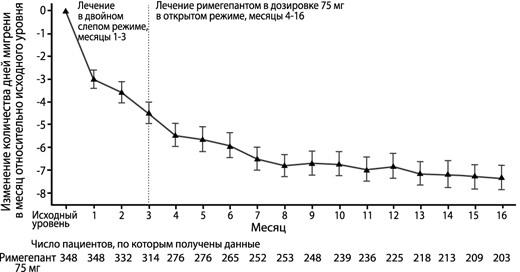
Пациентам, участвовавшим в исследовании 4, была предоставлена возможность продолжить участие в открытом продленном исследовании в течение дополнительных 12 месяцев. Эффективность сохранялась в течение 1 года в открытом продленном исследовании, в котором пациенты принимали римегепант в дозе 75 мг через день и при необходимости вне графика приема препарата (рисунок 4). Из общего количества участников, 203 пациента, которым был назначен римегепант, прошли весь 16-месячный период лечения. У этих пациентов общее среднее уменьшение количества дней мигрени в месяц, усредненного за 16 месяцев лечения, относительно исходного уровня составило 6.2 дня.
Рисунок 4. График изменения среднемесячного числа дней мигрени в течение периода наблюдения во время фаз двойного слепого режима (месяцы с 1 по 3) и открытого режима (месяцы с 4 по 16) относительно исходного уровня
Данные доклинической безопасности
В ходе стандартных доклинических исследований фармакологической безопасности, токсичности многократных доз, генотоксичности, канцерогенности и токсического влияния на репродуктивную функцию и развитие потомства не было выявлено особой опасности римегепанта для человека.
Связанные с римегепантом эффекты при более высоких дозах, которые возникали в исследованиях многократных доз, включали липидоз печени у мышей и крыс, внутрисосудистый гемолиз у крыс и обезьян и рвоту у обезьян. Эти эффекты наблюдались только при экспозициях, которые считались в достаточной степени превышающими максимальную экспозицию у человека, что указывает на малую значимость для клинического применения (выше минимум в 12 раз мыши и минимум в 49 раз (крысы в случае липидоза печени; выше минимум в 95 раз (крысы и минимум 9 раз (обезьяны в.
случае внутрисосудистого гемолиза и выше минимум в 37 раз в случае рвоты (обезьяны).
В исследовании фертильности крыс связанные с римегепантом эффекты отмечались только при высокой дозе 150 мг/кг/сут (снижение фертильности и повышение частоты предимплантационной гибели), которая вызывала токсичность у матери и экспозицию, минимум в 95 раз превышающее максимальную экспозицию у человека. Пероральный прием римегепанта в период органогенеза оказывал нежелательное воздействие на плод у крыс, но не у кроликов. У плодов крыс снижение массы тела и учащение случаев пороков развития наблюдались только при самой высокой дозе 300 мг/кг/сут, которая вызывала токсичность у матери при экспозиции, приблизительно в 200 раз превышающей максимальную экспозицию у человека. Кроме того, римегепант не оказывал влияния пренатальное и постнатальное развитие у крыс при дозах до 60 мг/кг/сут (минимум в 24 раза выше максимальной степени воздействия у человека), а также на рост, развитие репродуктивную функцию молодых крыс при дозах до 45 мг/кг/сут (минимум в 14 раз выше максимальной экспозиции у человека).
Фармакокинетика
Всасывание
После перорального приема римегепант всасывается с достижением Cmax через 1.5 ч. После приема дозы 300 мг, превышающей терапевтическую, абсолютная биодоступность римегепанта составляла приблизительно 64%.
Влияние приема пищи. Время достижения Cmax римегепанта (Тmax) после приема пищи увеличивалось на 1-1.5 ч в зависимости от уровня содержания жира в пище. Пища с высоким содержанием жиров уменьшала Cmax на 42-53% и AUC на 32-38%. Пища с низким содержанием жиров уменьшала Cmax на 36% и AUC на 28%. В исследованиях клинической безопасности и эффективности римегепант применяли без учета времени приема пищи.
Распределение
Vd римегепанта в равновесном состоянии составляет 120 л. Связывание римегепанта с белками плазмы составляет примерно 96%
Метаболизм
Римегепант метаболизируется преимущественно изоферментом CYP3A4 и в меньшей степени CYP2C9. Римегепант представляет собой основную форму (примерно 77%), при этом в плазме не обнаруживаются его основные метаболиты (т.е. >10%).
По результатам исследований iп vitro римегепант не ингибирует CYP1A2, 2В6, 2С9, 2С19, 2D6 или UGT1A1 при клинически значимых концентрациях. Однако римегепант вызывает слабое ингибирование CYP3A4, зависимое от времени. Римегепант не индуцирует CYP1A2, CYP2B6 или CYP3A4 при клинически значимых концентрациях.
Выведение
T1/2 римегепанта составляет примерно 11 ч у здоровых пациентов. После перорального приема [14С)-римегепанта здоровыми испытуемыми мужского пола 78% от общего объема радиоактивно меченого вещества выводилось с калом и 24% - с мочой. Римегепант в неизмененном виде является основным отдельным компонентом, выделяемым с калом (42%) и мочой (51%).
Транспортеры
In vitro римегепант является субстратом эффлюксных транспортеров P-gp и BCRP. Ингибиторы эффлюксных транспортеров P-gp и BCRP могут повышать концентрацию римегепанта в плазме (см. раздел "Лекарственное взаимодействие"). Римегепант не является субстратом OATP1B1 или ОАТР!ВЗ. Ввиду низкого почечного клиренса римегепант не изучался как субстрат OAT1, ОАТ3, ОСТ2, МАТЕ или МАТЕ2-К. Римегепант не ингибирует P-gp, BCRP, OAT1 или МАТЕ2-К при клинически значимых концентрациях. Он слабо ингибирует OATP1B1 и ОАТЗ. Римегепант является ингибитором ОАТР1В3, ОСТ2 и МАТЕ1. Одновременное применение римегепанта с метформином, субстратом транспортера МАТЕ1, не оказывало клинически значимого влияния ни на фармакокинетику метформина, ни на утилизацию. глюкозы. Клинического лекарственного взаимодействия римегепанта с ОАТР1В3 или ОСТ2 при клинически значимых концентрациях не ожидается.
Линейность (нелинейность)
После однократного перорального приема экспозиция римегепанта повышается более чем пропорционально дозе, что, по-видимому, связано с дозозависимым повышением биодоступности.
Особые группы пациентов
Возраст, пол, масса тела, раса, этническая принадлежность
Не наблюдалось клинически значимых различий фармакокинетики римегепанта в зависимости от возраста, пола, расы/этнической принадлежности, массы тела, статуса мигрени или генотипа CYP2C9.
Пациенты с нарушением функции почек
В клиническом исследовании, специально проведенном для сравнения фармакокинетики римегепанта у испытуемых с легким (расчетный КК 60-89 мл/мин), умеренным (КК 30-59 мл/мин) или тяжелым нарушением функции почек (КК 15-29 мл/мин) с фармакокинетикой римегепанта у испытуемых с нормальной функцией почек (соответствующая контрольная группа здоровых добровольцев), после приема одной дозы 75 мг наблюдалось увеличение экспозиции римегепанта менее чем на 50%. У испытуемых с тяжелым нарушением функции почек значение AUC несвязанного римегепанта было в 2.57 раза выше. Применение препарата Нуртек у пациентов с терминальной стадией почечной недостаточности (КК < 15 мл/мин) не изучалось.
Пациенты с нарушением функции печени
В клиническом исследовании, специально проведенном для сравнения фармакокинетики римегепанта у испытуемых с легким, умеренным или тяжелым нарушением функции печени и у испытуемых с нормальной функцией печени (соответствующая контрольная группа здоровых добровольцев), после приема одной дозы 75 мг у испытуемых с тяжелым нарушением функции печени (класс С по классификации Чайлда-Пью) экспозиция римегепанта (AUC несвязанного препарата) была в 3.89 раза выше. Клинически значимых различий в экспозиции у испытуемых с легким (класс А по классификации Чайлда-Пью) и средним нарушением функции печени (класс В по классификации Чайлда-Пью) в сравнении с испытуемыми с нормальной функцией печени не наблюдалось.
Показания препарата Нуртек
- для купирования приступов мигрени с аурой и без ауры и профилактического лечения эпизодической мигрени у взрослых от 18 лет, имеющих не менее 4 приступов мигрени в месяц.
| Код МКБ-10 | Показание |
| G43.0 | Мигрень без ауры [простая мигрень] |
| G43.1 | Мигрень с аурой [классическая мигрень] |
| G43.9 | Мигрень неуточненная |
Режим дозирования
Купирование приступа мигрени
Рекомендуемая доза составляет 75 мг римегепанта по мере необходимости, 1 раз/сут.
Профилактика мигрени
Рекомендуемая доза составляет 75 мг римегепанта через день.
Максимальная суточная доза составляет 75 мг римегепанта.
Сопутствующие лекарственные препараты
Следует избегать приема следующей дозы римегепанта в течение 48 ч, если одновременно с ним применяются умеренные ингибиторы CYP3A4 или ингибиторы Р-гликопротеина (P-gp) (см. раздел "Лекарственное взаимодействие").
Особые группы пациентов
Опыт применения римегепанта у пациентов в возрасте 65 лет и старше ограничен. Коррекция дозы не требуется, поскольку возраст не влияет на фармакокинетику римегепанта (см. раздел "Фармакокинетика").
У пациентов с легким, умеренным или тяжелым нарушением функции почек коррекция дозы не требуется. Тяжелое нарушение функции почек приводило к увеличению AUC несвязанного препарата более чем в 2 раза, однако общее значение AUC увеличивалось менее чем на 50% (см. раздел "Фармакокинетика"). Следует проявлять осторожность при частом приеме препарата пациентами с тяжелым нарушением функции почек. Применение римегепанта не изучалось у пациентов с терминальной стадией почечной недостаточности и у пациентов, находящихся на диализе. Не следует применять римегепант у пациентов с терминальной стадией почечной недостаточности (КК < 15 мл/мин).
У пациентов с легким (класс А по классификации Чайлд-Пью) или умеренным (класс В по классификации Чайлд-Пью) нарушением функции печени коррекция дозы не требуется. Концентрация римегепанта в плазме крови (AUC несвязанного препарата) была значительно выше у пациентов с тяжелым нарушением функции печени (класс С по классификации Чайлд-Пью) (см. раздел "Фармакокинетика"). Не следует применять римегепант у пациентов с тяжелым нарушением функции печени.
Безопасность и эффективность препарата Нуртек у детей и подростков в возрасте до 18 лет не установлены. Данные отсутствуют.
Способ применения
Препарат Нуртек предназначен для приема внутрь.
Таблетки, диспергируемые в полости рта, следует помещать на язык или под него. Лекарственный препарат будет растворяться во рту, и его можно принимать без жидкости.
Препарат Нуртек можно принимать вне зависимости от приема пищи.
Следует рекомендовать пациентам вскрывать блистер сухими руками и ознакомиться со всеми указаниями, изложенными в листке-вкладыше.
Побочное действие
Наиболее частой нежелательной реакцией была тошнота при купировании приступа (1.2%) и при профилактике мигрени (1.4%). Большинство реакций были легкой и средней степени тяжести. Гиперчувствительность, включая одышку и сильную сыпь, возникала менее чем у 1% пациентов, получавших препарат.
В таблице 1 представлен перечень нежелательных реакций при применении римегепанта в зависимости от системно-органного класса (СОК) словаря MedDRA и частоты.
Соответствующая категория частоты для каждой лекарственной реакции определяется следующим образом (согласно CIOMS III): очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000); частота неизвестна (на основании имеющихся данных оценить невозможно.
Таблица 3. Список нежелательных реакций
| Системно-органный класс | очень часто (≥1/10) | часто (≥1/100, но <1/10) | нечасто (≥1/1000, но <1/100) |
| Купирование приступа | |||
| Со стороны иммунной системы | Гиперчувствительность, включая одышку и сильную сыпь | ||
| Со стороны ЖКТ | Тошнота | ||
| Профилактика | |||
| Со стороны ЖКТ | Тошнота | ||
Долгосрочная безопасность
Долгосрочную безопасность римегепанта оценивали в двух открытых продленных, исследованиях длительностью один год; 1662 пациента принимали римегепант в течение не менее 6 месяцев и 740 пациентов принимали римегепант в течение 12 месяцев для купирования приступов или для профилактического лечения мигрени.
Описание отдельных нежелательных реакций
Реакции гиперчувствительности
Гиперчувствительность, включая одышку и сильную сыпь, возникала менее чем у 1% пациентов, принимавших препарат в рамках клинических исследований. Реакции гиперчувствительности могут возникать через несколько дней после приема препарата, а также наблюдалась отсроченная серьезная гиперчувствительность.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к римегепанту или к любому из вспомогательных веществ, входящих в состав препарата.
Применение при беременности и кормлении грудью
Беременность
Имеются ограниченные данные по применению римегепанта у беременных женщин. В ходе исследований на животных римегепант не вызывал смерть эмбрионов и не проявлял тератогенность при клинически значимых экспозициях препарата. Нежелательные эффекты на эмбриофетальное развитие (снижение массы тела плода и увеличение количества скелетных отклонений у крыс) после введения римегепанта во время беременности наблюдались только при экспозициях, ассоциируемых с развитием токсичности у матери (приблизительно в 200 раз превышающих экспозиции при клиническом применении). В целях безопасности желательно избегать применения препарата Нуртек во время беременности.
Период грудного вскармливания
В одноцентровом исследовании с участием 12 кормящих грудью женщин, получивших одну дозу римегепанта 75 мг, в грудном молоке наблюдались минимальные концентрации римегепанта, Согласно расчетам, относительная процентная доля дозы матери, передавшаяся младенцу, составляет менее 1%. Данные о влиянии на выработку грудного молока отсутствуют. Следует учитывать пользу грудного вскармливания для развития и здоровья ребенка, клиническую необходимость применения препарата Нуртек для матери и любые потенциальные нежелательные эффекты римегепанта или основного заболевания матери на младенца, находящегося на грудном вскармливании.
Фертильность
В исследованиях на животных не было выявлено клинически значимого влияния на фертильность самок и самцов (см. раздел "Фармакологическое действие" Данные доклинической безопасности).
Применение при нарушениях функции печени
Применение при нарушениях функции почек
У пациентов с легким, умеренным или тяжелым нарушением функции почек коррекция дозы не требуется. Следует проявлять осторожность при частом приеме препарата пациентами с тяжелым нарушением функции почек. Применение римегепанта не изучалось у пациентов с терминальной стадией почечной недостаточности и у пациентов, находящихся на диализе. Не следует применять римегепант у пациентов с терминальной стадией почечной недостаточности (КК < 15 мл/мин).
Применение у детей
Применение у пожилых пациентов
Особые указания
Реакции гиперчувствительности, включая одышку и сыпь, наблюдались менее чем у 1% пациентов, принимавших римегепант в рамках клинических исследований ( см. раздел "Побочное действие"). Реакции гиперчувствительности, в т.ч. серьезные, могут возникать через несколько дней после приема препарата. При возникновении реакции гиперчувствительности следует прекратить прием римегепанта и начать соответствующее лечение.
Препарат Нуртек не рекомендуется применять в следующих случаях:
- у пациентов с тяжелым нарушением функции печени ( см. раздел "Режим дозирования");
- у пациентов с терминальной стадией почечной недостаточности (КК < 15 мл/мин) ( см. раздел "Режим дозирования");
- одновременно с сильными ингибиторами CYP3A4 (см. раздел "Лекарственное взаимодействие");
- одновременно с сильными или умеренными индукторами CYP3A4 ( см. раздел "Лекарственное взаимодействие").
Абузусная головная боль (АГБ)
Чрезмерное употребление любых видов лекарственных препаратов для лечения головной боли может усугубить ее. Если у пациента наблюдается или предполагается это ·состояние, необходимо обратиться за медицинской помощью и прекратить лечение.
Диагноз АГБ следует подозревать у пациентов с частыми или ежедневными головными болями, возникающими несмотря на регулярное применение препаратов для лечения острой головной боли (или по причине их применения).
Вспомогательные вещества
Препарат Нуртек содержит сукралозу, поэтому пациентам с редко встречающейся· наследственной непереносимостью фруктозы, глюкозо-галактозной мальабсорбцией или дефицитом сахаразы-изомальтазы не следует принимать этот препарат.
Препарат содержит маннитол, который может оказывать слабое слабительное действие.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Нуртек не оказывает влияния или оказывает несущественное влияние на способность управлять транспортными средствами и работать с механизмами.
Передозировка
Симптомы: клинический опыт передозировки римегепантом ограничен. О симптомах передозировки не сообщалось.
Лечение передозировки римегепантом должно состоять из общих поддерживающих мероприятий, включающих мониторинг основных показателей жизнедеятельности организма и наблюдение за клиническим состоянием пациента. Специфический антидот для лечения передозировки римегепанта отсутствует. Маловероятно, что диализ в значительной степени повлияет на выведение римегепанта из организма из-за высокой степени его связывания с белками сыворотки крови.
Лекарственное взаимодействие
Римегепант является субстратом изофермента CYP3A4 и эффлюксных транспортеров P-gp и белка резистентности рака молочной железы (BCRP) (см. раздел "Фармакокинетика").
Ингибиторы CYP3A4
Ингибиторы CYP3A4 повышают концентрацию римегепанта в плазме крови. Совместное применение римегепанта с сильными ингибиторами CYP3A4 (например, с кларитромицином, итраконазолом, ритонавиром) не рекомендуется (см. раздел "Особые указания"). Одновременное применение римегепанта с итраконазолом приводило к значительному повышению экспозиции (концентрации в плазме) римегепанта (AUC - в 4 раза, Cmax - в 1.5 раза).
Одновременное применение римегепанта с лекарственными препаратами, умеренно ингибирующими CYP3A4 (например, с дилтиаземом, эритромицином, флуконазолом); может повышать экспозицию римегепанта. Одновременное применение римегепанта с флуконазолом приводило к повышению экспозиции римегепанта (AUC - в 1.8 раза) без существенного влияния на Cmax. Следует избегать приема следующей дозы римегепанта в течение 48 ч, если одновременно с ним принимаются умеренные ингибиторы CYP3A4-(например, флуконазол) (см. раздел "Режим дозирования").
Индукторы CYP3A4
Индукторы CYP3A4 снижают концентрацию римегепанта в плазме крови. Одновременное применение препарата Нуртек с сильными индукторами CYP3A4 (например, с фенобарбиталом, рифампицином, зверобоем продырявленным (Hypericum perforatum)) или с умеренными индукторами CYP3A4 (например, с бозентаном, эфавирензом,' модафинилом) не рекомендуется (см. раздел "Особые указания"). Эффект индукции CYP3A4 может длиться до 2 недель после прекращения применения сильного или умеренного индуктора CYP3A4. Одновременное применение римегепанта с рифампицином приводило к значительному снижению экспозиции римегепанта (снижение AUC на 80% и Cmax на 64 %), что может привести к снижению эффективности препарата.
Препараты, ингибирующие только P-gp и BCRP
Ингибиторы эффлюксных транспортеров P-gp и BCRP могут повышать концентрацию римегепанта в плазме крови. Следует избегать приема следующей дозы препарата Нуртек в течение 48 ч, если одновременно с ним применяются сильные ингибиторы P-gp (например, циклоспорин, верапамил, хинидин) (см. раздел "Режим дозирования"). Одновременное
применение римегепанта с циклоспорином (сильным ингибитором P-gp и BCRP) или хинидином (селективным ингибитором P-gp) приводило к значительному и аналогичному повышению экспозиции римегепанта (AUC и Cmax - более чем на 50%, но менее чем в 2 раза).
Условия хранения препарата Нуртек
Срок годности препарата Нуртек
Условия реализации
Контакты для обращений
ПФАЙЗЕР (США)

|
|
Представительство в России |
X







