Икервис® (Ikervis®) инструкция по применению
- 📜 Инструкция по применению Икервис®
- 💊 Состав препарата Икервис®
- ✅ Применение препарата Икервис®
- 📅 Условия хранения Икервис®
- ⏳ Срок годности Икервис®
Владелец регистрационного удостоверения:
Лекарственная форма
|
|
Икервис® |
Капли глазные 1 мг/1 мл: тюбики-капельницы 0.3 мл 30 шт.
рег. №: ЛП-(000678)-(РГ-RU)
от 11.04.22
- Действующее
|
Форма выпуска, упаковка и состав препарата Икервис®
Капли глазные в виде эмульсии молочно-белого цвета.
| 1 мл | 1 тюбик-капельница | |
| циклоспорин | 1 мг | 0.3 мг |
Вспомогательные вещества: триглицериды среднецепочечные, тилоксапол, цеталкония хлорид, глицерол, полоксамер 188, 0.1M раствор натрия гидроксида (для коррекции pH), вода д/и.
0.3 мл - тюбики-капельницы полиэтиленовые одноразовые× (5) - пакеты запаянные из фольги алюминиевой ламинированной (6) - пачки картонные.
× скрепленные в 1 стрип по 5 тюбик-капельниц.
Фармакологическое действие
Механизм действия и фармакодинамические эффекты
Циклоспорин (также известный как циклоспорин А) является циклическим полипептидным иммуномодулятором с иммунодепрессивными свойствами. Было установлено, что он продлевает выживаемость аллогенных трансплантатов у животных и значительно улучшает приживаемость трансплантата при всех типах трансплантации солидных органов у человека. Также было продемонстрировано, что циклоспорин оказывает противовоспалительное действие. Результаты исследований на животных подтвердили, что циклоспорин ингибирует развитие клеточно-опосредованных реакций. Было отмечено, что циклоспорин ингибирует продукцию и/или высвобождение противовоспалительных цитокинов, включая интерлейкин 2 (IL-2) или фактор роста Т-клеток (TCGF). Также известно, что он активирует высвобождение противовоспалительных цитокинов. Циклоспорин, по-видимому, блокирует неактивные лимфоциты в фазе G0 или G1 клеточного цикла. Все имеющиеся данные свидетельствуют о том, что циклоспорин действует на лимфоциты специфически и обратимо, не подавляет кроветворение и не оказывает какого-либо воздействия на функцию фагоцитарных клеток.
У пациентов с синдромом сухого глаза, связанного с иммуновоспалительным механизмом, после введения в глаза циклоспорин пассивно абсорбируется в инфильтраты Т-лимфоцитов в роговице и конъюнктиве глаза и инактивирует кальциневринфосфатазу.
Циклоспорин-индуцированная инактивация кальциневрина ингибирует дефосфорилирование фактора транскрипции ядерного фактора активированных Т-клеток (NF-AT) и предотвращает перемещение NF-AT в ядро, блокируя, таким образом, высвобождение противовоспалительных цитокинов, таких как IL-2.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Икервис® оценивались в двух двойных слепых плацебо-контролируемых рандомизированных клинических исследованиях с участием взрослых пациентов с синдромом сухого глаза (синдром сухого глаза), которые соответствовали критериям Международной рабочей группы по синдрому сухого глаза (DEWS).
В 12-месячном, двойном, плацебо-контролируемом базовом клиническом исследовании (исследование SANSIKA), 246 пациентов с синдромом сухого глаза (ССГ) сопровождающимся тяжелым кератитом [тяжесть которого определялась с помощью окрашивания роговицы флуоресцеином (CFS) на 4 балла по модифицированной оксфордской шкале] были в случайном порядке по исследуемым группам, в которых они получали перед сном в течение 6 месяцев или по одной капле в день препарата Икервис® или плацебо. Пациенты, рандомизированные в группу плацебо, через 6 месяцев были переведены на препарат Икервис®. В качестве первичной конечной точки эффективности был определен процент пациентов, достигших к 6 месяцу терапии улучшения кератита (CFS) не менее чем на два балла и на 30% улучшения симптомов, оцениваемых с помощью индекса заболевания поверхности глаза (OSDI). Процент пациентов, ответивших на лечение, в группе препарата Икервис® составлял 28.6%, по сравнению с 23.1% в группе плацебо. Разница не была статистически значимой (р=0.326).
Степень тяжести кератита, которая оценивалась с помощью CFS, значительно уменьшилась через 6 месяцев по сравнению с исходными данными при применении препарата Икервис® по сравнению с плацебо (среднее изменение по сравнению с исходным уровнем составило -1.764 при в группе препарата Икервис® и -1.418 при применении плацебо, p=0.037). Процентное соотношение пациентов, получавших препарат Икервис®, у которых наблюдалось улучшение значений CFS на 3 балла через 6 месяцев (с 4 до 1), составило 28.8% по сравнению с 9.6% в группе плацебо, однако этот анализ был ретроспективным, что ограничивает устойчивость оценки значимости исхода. Благоприятное воздействие на кератит сохранялось в открытой фазе исследования с 6 месяца по 12 месяц.
Среднее изменение по сравнению с исходными данными по шкале OSDI из 100 пунктов составило -13.6 в группе препарата Икервис® и -14.1 в группе плацебо через 6 месяцев (р=0.858). Кроме того, в группе препарата Икервис® по сравнению с группой плацебо через 6 месяцев отсутствовали улучшения по другим вторичным конечным точкам, включая бальную оценку дискомфорта в глазах, результаты теста Ширмера, сопутствующего применения препаратов "искусственных слез", общую оценку эффективности исследователем, время разрыва слезной пленки, окрашивание лиссамином зеленым, балл по шкале качества жизни и осмолярность слезной жидкости.
Уменьшение воспалительных изменений на поверхности глаза, оцениваемые на основе экспрессии антигена человеческих лейкоцитов DR (HLA-DR) (поисковая конечная точка), преобладало через 6 месяцев в группе препарата Икервис® (р=0.021).
В 6-месячном двойном слепом плацебо-контролируемом клиническом исследовании (SICCANOVE) 492 пациентов с синдромом сухого глаза, сопровождающимся умеренным или тяжелым кератитом (который характеризовался 2-4 баллами по шкале CFS), также была произведена рандомизация с распределением по группам препарата Икервис® и плацебо с последующим введением исследуемого препарата перед сном на протяжении 6 месяцев. Составными главными конечными точками оценки эффективности были изменение значений по шкале CFS, а также изменение значений по общей шкале дискомфорта в глазах вне связи с исследуемым препаратом через 6 месяцев. Небольшое, но статистически значимое различие улучшения по шкале CFS наблюдалось между исследуемыми группами на 6 месяце в пользу препарата Икервис® (среднее изменение значений по шкале CFS по сравнению с исходными данными составило -1.05 в группе препарата Икервис® и -0.82 в группе плацебо, р=0.009).
Среднее изменение дискомфорта в глазах (который оценивался с использованием Визуальной аналоговой шкалы) по сравнению с исходными данными составило -12.82 в группе препарата Икервис® и -11.21 в группе плацебо через 6 месяцев (р=0.808).
В обоих исследованиях при применении препарата Икервис® по сравнению с плацебо не отмечалось преимуществ через 6 месяцев лечения, как при использовании визуальной аналоговой шкалы (VAS), так и OSDI.
В обоих исследованиях в среднем треть пациентов страдали синдромом Шегрена; в общей популяции отмечалось статистически значимое улучшение CFS при применении препарата Икервис®, а также значимое уменьшение выраженности симптомов.
После завершения участия в исследовании SANSIKA (12-месячное исследование) пациентам предлагалось перейти в исследование Post SANSIKA. Это исследование было открытым не рандомизированным 24-месячным дополнительным исследованием к исследованию SANSIKA с участием одной группы пациентов. В исследовании Post SANSIKA пациенты получали препарат Икервис® или не получали никакого лечения в зависимости от значений по шкале CFS (пациенты получали препарат Икервис®, когда наблюдалось усугубление кератита).
Целью исследования было наблюдение за долгосрочной эффективностью и частотой рецидивов у пациентов, прежде получавших препарат Икервис®.
Основная цель исследования состояла в оценке продолжительности улучшения после прекращения применения препарата Икервис® от момента наступления этого улучшение по сравнению с исходными данными в исследовании SANSIKA (т.е., как минимум, на 2 балла по модифицированной Оксфордской шкале).
В исследование были включены 67 пациентов (37.9% из 177 пациентов, завершивших участие в исследовании SANSIKA). Через 24 месяца у 61.3% из 62 пациентов, включенных в популяцию для первичной оценки эффективности, по данным шкалы CFS, рецидивы отсутствовали. Процентное отношение пациентов, у которых произошел тяжелый рецидив кератита, составило 35% и 48%, получавших в исследовании SANSIKA препарат Икервис® в течение 12 месяцев и 6 месяцев, соответственно.
На основании первой квартили (медиана не подлежала оценке в связи с небольшим числом рецидивов) продолжительность периода до наступления рецидива (до 4 степени CFS) составила ≤244 дней и ≤175 дней у пациентов, получавших препарат Икервис® в течение 12 месяцев и 6 месяцев, соответственно. Пациенты провели больше времени со 2 степенью по шкале CFS (медиана 12.7 недель/год) и 1 степенью (медиана 6.6 недель/год), чем с 3 степенью по шкале CFS (медиана 2.4 недель/год) и с 4 и 5 степенями по шкале CFS (медиана 0 недель/год).
Оценка симптомов ССГ с помощью VAS показала усиление дискомфорта у пациентов с момента первого прекращения лечения до момента возобновления лечения, за исключением боли, которая оставалась относительно слабой и стабильной. Медиана значений по шкале VAS в целом увеличилась с момента первого прекращения лечения (23.3%) до момента возобновления лечения (45.1%).
Значимые изменения в отношении других вторичных конечных точек (TBUT, окрашивание лиссамином зеленым и тест Ширмера, NEI-VFQ и EQ-5D) в ходе дополнительного исследования не наблюдались.
Данные доклинической безопасности
В доклинических исследованиях, включая радиационные исследования по фармакологической безопасности, токсичности при многократном применении, фототоксичности и фотоаллергии, генотоксичности, канцерогенному риску, токсическому действию на репродуктивную функцию и развитие плода, не выявлены опасности для человека.
В доклинических исследованиях эффекты препарата наблюдались только при его системном применении либо в случаях, когда степень воздействия препарата существенно превосходила максимально возможную степень воздействия у человека, указывая на небольшую значимость этих данных для клинического применения.
Фармакокинетика
Формальных фармакокинетических исследований по применению препарата Икервис® у человека не проводилось.
Концентрация препарата Икервис® в крови измерялась с помощью особого анализа жидкостной хроматографии высокого давления-масс-спектрометрии. У 374 пациентов в двух исследованиях по изучению эффективности измерялась концентрация циклоспорина в плазме крови перед назначением препарата и спустя 6 месяцев лечения (исследования SICCANOVE и SANSIKA), а также спустя 12 месяцев лечения (исследование SANSIKA). После применения препарата Икервис® на протяжении 6 месяцев 1 раз/сут у 327 пациентов этот показатель был ниже нижнего предела обнаружения (0.050 нг/мл), а у 35 пациентов - ниже нижнего предела количественного определения (0.100 нг/мл).
У восьми пациентов определялись измеряемые значения, не превышающие 0.206 нг/мл, которые можно считать пренебрежимо малыми. У троих пациентов показатели превосходили верхний предел количественного определения (5 нг/мл), однако они уже принимали циклоспорин внутрь в постоянной дозе, что допускалось протоколом исследования. После 12 месяцев лечения значения были ниже предела обнаружения у 56 пациентов и ниже нижнего предела количественного определения у 19 пациентов. У семи пациентов определялись измеримые значения от 0.105 до 1.27 нг/мл, которые посчитали пренебрежимо малыми. У двоих пациентов показатели превосходили верхний предел количественного определения, однако они также принимали циклоспорин внутрь в постоянной дозе с момента включения в исследование.
Показания препарата Икервис®
- лечение тяжелого кератита у взрослых пациентов с синдромом сухого глаза в случае неэффективности терапии препаратами искусственной слезы (см. раздел "Фармакологическое действие").
| Код МКБ-10 | Показание |
| H04.1 | Другие болезни слезной железы (синдром сухого глаза) |
| H16 | Кератит |
Режим дозирования
Лечение должно быть назначено офтальмологом или медицинским специалистом, имеющим квалификацию в офтальмологии.
Рекомендуемая доза - по 1 капле в пораженный(е) глаза (глаз) 1 раз/сут перед сном. Длительность терапии препаратом Икервис® зависит от выраженности симптомов заболевания и переносимости терапии. Максимальная длительность терапии препаратом Икервис® по данным клинических наблюдений составляет около 24 мес.
Эффективность лечения следует оценивать, как минимум, через каждые 6 месяцев.
При пропуске дозы, лечение следует продолжить со следующего дня в обычном режиме. Пациентам необходимо рекомендовать не закапывать более одной капли в пораженный(е) глаз(а).
Особые группы пациентов
Пациенты пожилого возраста
Применение препарата у пациентов пожилого возраста изучалось в клинических исследованиях. Коррекция дозы не требуется.
Пациенты с нарушением функции почек или печени
Эффект циклоспорина не изучался у пациентов с нарушениями функции почек или печени. Тем не менее, в этих группах пациентов каких-либо специальных мер не требуются.
Дети
Нет достаточного опыта применения циклоспорина для лечения тяжелого кератита у детей и подростков с синдромом сухого глаза в возрасте до 18 лет при отсутствии улучшений на фоне лечения препаратами искусственной слезы.
Способ применения
Местно, в виде инстилляций в конъюнктивальную полость.
Меры предосторожности перед применением препарата
Пациентов следует проинструктировать тщательно вымыть руки перед началом применения препарата.
Перед применением тюбик-капельницу для однократного применения следует осторожно встряхнуть.
Только для однократного применения. Содержимого одной тюбик-капельницы достаточно для закапывания в оба глаза. Любая неиспользованная эмульсия должна быть немедленно утилизирована.
Пациентов следует проинструктировать использовать носослезную окклюзию и закрывать веки на 2 минуты после закапывания, чтобы уменьшить системную абсорбцию. Это способствует уменьшению системных побочных эффектов и увеличению местной активности препарата.
При применении более одного местного офтальмологического препарата, их следует применять с 15-минутным интервалом. Препарат Икервис® должен применяться последним (см. раздел "Особые указания").
Инструкция по медицинскому применению лекарственного препарата
Вымыть руки.
Если пациент носит контактные линзы, необходимо снять их перед применением капель перед сном. Установить линзы после пробуждения.
Открыть алюминиевый пакет, который содержит 5 тюбик-капельниц для однократного применения.
Извлечь одну тюбик-капельницу для однократного применения из алюминиевого пакета.
Осторожно встряхнуть тюбик-капельницу перед применением.
Открутить крышку (рисунок 1).
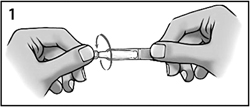
Рисунок 1
Опустить нижнее веко (рисунок 2).
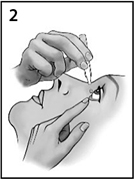
Рисунок 2
Откинуть голову назад и посмотреть на потолок.
Осторожно выдавить одну каплю препарата в глаз. Не следует касаться глаза кончиком тюбик-капельницы.
Моргнуть несколько раз, чтобы препарат распределился по всему глазу.
После применения препарата Икервис® следует аккуратно прижать пальцем угол глаза к носу и закрыть веки на 2 минуты (рисунок 3). Это поможет предотвратить попадание препарата Икервис® в системный кровоток.
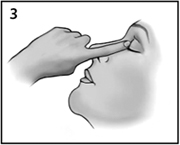
Рисунок 3
Если пациент использует препарат в оба глаза, следует повторить все перечисленные этапы и для другого глаза.
Необходимо утилизировать тюбик-капельницу сразу после применения, даже если в ней еще осталось немного жидкости.
Оставшиеся тюбик-капельницы для однократного применения следует хранить в оригинальной упаковке.
Если капля не попала в глаз, следует повторить действия еще раз.
Побочное действие
Резюме профиля безопасности
Среди нежелательных реакций (НР) наиболее часто отмечались боль в глазах (19.2%), раздражение глаз (17.8%), слезотечение (6.4%), гиперемия глаз (5.5%), а также эритема век (1.7%), которые обычно носили преходящий характер и возникали во время закапывания препарата. Эти НР согласуются с реакциями, о которых сообщалось в ходе постмаркетингового применения.
Табличное резюме нежелательных реакций
Следующие НР, указанные ниже, наблюдались в клинических исследованиях или в ходе постмаркетингового применения. Они упорядочены в соответствии с системно-органной классификацией и систематизированы в соответствии со следующей конвенцией: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно).
| Класс системы органов | Частота | Нежелательные реакции |
| Инфекции и инвазии | Нечасто | Бактериальный кератит Опоясывающий герпес с поражением глаз |
| Со стороны органа зрения | Очень часто | Боль в глазах Раздражение глаз |
| Часто | Эритема век Повышенное слезоотделение Гиперемия глаз Затуманенное зрения Отек век Гиперемия конъюнктивы Зуд глаз | |
| Нечасто | Нарушение слезоотделения Выделения из глаз Раздражение конъюнктивы Конъюнктивит Ощущение инородного тела в глазах Преципитаты глаз Кератит Блефарит Халазион Инфильтраты роговицы Рубец роговицы Зуд век Иридоциклит Дискомфорт в глазах | |
| Общие расстройства и нарушения в месте введения | Нечасто | Реакция в месте инсталляции |
| Со стороны нервной системы | Нечасто | Головная боль |
Описание отдельных нежелательных реакций
Боль в глазах
Боль в месте инстилляции была частой местной побочной реакцией, связанной с применением препарата Икервис® во время клинических испытаний. Вполне вероятно, что это связано с применением циклоспорина.
Генерализованные и местные инфекции
Пациенты, получающие иммуносупрессивную терапию, включая циклоспорин, подвергаются повышенному риску инфекций. Могут развиваться как генерализованные, так и местные инфекции. Существующие инфекции также могут обостриться (см. раздел "Противопоказания"). Тем не менее о случаях инфекций, связанных с применением препарата Икервис® сообщалось редко.
В качестве меры предосторожности следует принять меры по снижению системной абсорбции (см. раздел "Режим дозирования").
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск" лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальную систему сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к циклоспорину и/или к любому из вспомогательных веществ, входящих в состав препарата;
- офтальмологические или периокулярные злокачественные новообразования или предраковые состояния;
- активная или предполагаемая глазная или периокулярная инфекция.
Применение при беременности и кормлении грудью
Женщины с детородным потенциалом/контрацепция у женщин
Препарат Икервис® не рекомендуется применять женщинам с детородным потенциалом, не использующим эффективную контрацепцию.
Беременность
Данные о применении препарата Икервис® у беременных женщин отсутствуют.
В исследованиях на животных обнаружена репродуктивная токсичность после системного введения циклоспорина в дозах, существенно превышающих максимальные дозы у человека, что указывает на практическое отсутствие репродуктивной токсичности при клиническом применении препарата Икервис®.
Препарат Икервис® не рекомендуется применять во время беременности, если только возможная польза для матери не превышает потенциальный риск для плода.
Период грудного вскармливания
После приема внутрь циклоспорин поступает в грудное молоко. Сведений о влиянии циклоспорина на новорожденных/грудных детей недостаточно. Однако при терапевтических дозах циклоспорина в глазных каплях, маловероятно, что его значимое количество будет присутствовать в грудном молоке. Необходимо принять решение либо о прекращении грудного вскармливания, либо об отмене терапии препаратом Икервис®, принимая во внимание пользу грудного вскармливания для ребенка и пользу терапии для женщины.
Фертильность
Данные о влиянии препарата Икервис® на репродуктивную функцию человека отсутствуют.
У животных, получавших циклоспорин в/в, негативное влияние на фертильность не отмечали (см. подраздел "Данные доклинической безопасности").
Применение при нарушениях функции печени
Применение при нарушениях функции почек
Применение у детей
Применение у пожилых пациентов
Особые указания
Препарат Икервис® не изучали у пациентов с офтальмологическими формами герпеса в анамнезе и, следовательно, он должен применяться у таких пациентов с осторожностью.
Контактные линзы
Применение препарата у пациентов, носящих контактные линзы, не изучали. Рекомендуется тщательное наблюдение за состоянием пациентов с тяжелым кератитом.
Сопутствующая терапия
Опыт применения циклоспорина пациентами с глаукомой ограничен. При применении препарата в комплексной терапии глаукомы, включающей бета-адреноблокаторы, которые могут оказывать негативное влияние на секрецию слезы, требуется регулярный клинический контроль состояния роговицы.
Влияние на иммунную систему
Лекарственные препараты для применения в офтальмологии, оказывающие влияние на иммунную систему, в число которых входит и циклоспорин, могут оказывать отрицательное влияние, приводящее к развитию локальных инфекций и прогрессированию злокачественных образований. В связи с этим при многолетнем применении препарата рекомендуется регулярный контроль состояния глаз(а) не реже одного раза в 6 месяцев.
Вспомогательные вещества
Препарат Икервис® содержит цеталкония хлорид, который может вызывать раздражение глаз. При длительном применении пациенты должны находиться под наблюдением.
Учитывая возможное влияние цеталкония хлорида на контактные линзы при применении глазных капель перед сном следует снимать контактные линзы и повторно надевать их после пробуждения.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Икервис® оказывает умеренное влияние на способность управлять транспортными средствами и работать с механизмами.
Этот препарат может вызвать временное затуманивание зрения или другие нарушения зрения, которые могут повлиять на способность управлять транспортными средствами или работать с механизмами (см. раздел "Побочное действие"). Пациентам следует рекомендовать не управлять транспортными средствами или работать с механизмами до нормализации зрения.
Передозировка
Лекарственное взаимодействие
Исследований взаимодействия с другими лекарственными препаратами не проводилось.
Применение в комбинации с другими медицинскими препаратами, действующими на иммунную систему
Одновременное применение препарата Икервис® с глазными каплями, содержащими кортикостероиды, может усилить воздействие циклоспорина на иммунную систему (см. раздел "Особые указания").
Условия хранения препарата Икервис®
Препарат следует хранить в оригинальной упаковке (пачке) для защиты от света при температуре не выше 25°С. Не замораживать.
Срок годности препарата Икервис®
Сразу после применения утилизировать открытую тюбик-капельницу для однократного применения с любым количеством оставшейся эмульсии.
Условия реализации
Контакты для обращений
САНТЭН ООО (Россия)

|
|
105064 Москва, |
X



