Катиоланс® (Catiolanze) инструкция по применению
- 📜 Инструкция по применению Катиоланс®
- 💊 Состав препарата Катиоланс®
- ✅ Применение препарата Катиоланс®
- 📅 Условия хранения Катиоланс®
- ⏳ Срок годности Катиоланс®
Владелец регистрационного удостоверения:
Лекарственная форма
|
|
Катиоланс® |
Капли глазные 50 мкг/1 мл: тюбики-капельницы 0.3 мл 30 шт.
рег. №: ЛП-(010718)-(РГ-RU)
от 27.06.25
- Действующее
|
Форма выпуска, упаковка и состав препарата Катиоланс®
Капли глазные в виде жидкости белого цвета.
| 1 мл | 1 тюбик-капельница | |
| латанопрост | 50 мкг | 15 мкг |
Вспомогательные вещества: триглицериды среднецепочечные, цеталкония хлорид, полисорбат 80, глицерол, вода д/и.
0.3 мл - тюбики-капельницы полиэтиленовые одноразовые× (5) - пакеты запаянные из фольги алюминиевой ламинированной (6) - пачки картонные.
× скрепленные в 1 стрип по 5 тюбик-капельниц.
Фармакологическое действие
Механизм действия
Действующее вещество латанопрост, аналог простагландина F2α, является селективным агонистом простаноидных рецепторов FP, который снижает ВГД, усиливая отток внутриглазной жидкости.
Исследования показывают, что основным механизмом действия препарата является усиление увеосклерального оттока внутриглазной жидкости. Кроме того, также описано небольшое повышение пропускной способности оттока (снижение сопротивления оттоку).
Фармакодинамические эффекты
Снижение ВГД у человека начинается примерно через 3-4 ч после применения препарата, а максимальный эффект достигается через 8–12 ч. Гипотензивное действие сохраняется не менее 24 ч.
Базовые исследования показали, что латанопрост эффективен в виде монотерапии. Кроме того, были проведены клинические исследования по изучению комбинированного применения. К ним относятся исследования, демонстрирующие эффективность латанопроста в сочетании с антагонистами β-адренорецепторов (тимолол). Кратковременные (1 или 2 недели) исследования показывают, что эффект латанопроста является аддитивным в сочетании с адреномиметиками (дипивалил эпинефрин), пероральными ингибиторами карбоангидразы (ацетазоламид) и, по крайней мере, частично аддитивным с холинергическими агонистами (пилокарпин).
Латанопрост не оказывает существенного влияния на выработку внутриглазной жидкости. Латанопрост не оказывает влияния на гемато-водный барьер. При краткосрочном применении у пациентов с псевдофакией латанопрост не вызывал просачивания флуоресцеина в задний сегмент глаза. Латанопрост в терапевтических дозах не оказывает значимого фармакологического воздействия на сердечно-сосудистую или дыхательную системы.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Катиоланс® оценивали в одном базовом исследовании фазы III.
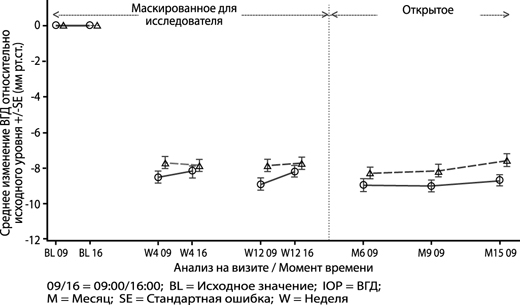
Исследование фазы III представляло собой одностороннее слепое, рандомизированное, контролируемое исследование не меньшей эффективности и безопасности эмульсии глазных капель Катиоланс®, по сравнению с раствором глазных капель латанопроста с консервантом бензалкония хлоридом. В исследовании принимали участие 386 взрослых пациентов с открытоугольной глаукомой (ОУГ) или внутриглазной гипертензией (ВГГ). В качестве первичной конечной точки было выбрано максимальное и минимальное изменение ВГД относительно исходного значения в группах лечения в течение 12-недельного периода лечения, при этом, изначально был установлен предел не меньшей эффективности 1.5 мм рт.ст. Исходные демографические данные и характеристики заболевания были схожими между группами пациентов, при этом общий средний возраст (SD) составил 63.1 года (11.16). Большинство (61.5%) пациентов составляли женщины, а 96.4% являлись представителями европеоидной расы. У 75.8% (n=291) пациентов была диагностирована первичная ОУГ и у 21.1% (n=81) - ВГГ; у остальных пациентов были диагностированы псевдоэксфолиативная глаукома (2.1%) и пигментная глаукома (1.0%).
Эффективность
Основной конечный показатель эффективности был достигнут, поскольку на 12-й неделе была продемонстрирована не меньшая эффективность препарата Катиоланс® по сравнению с 0.005% раствором латанопроста, содержащим консервант (см. Таблицу 2). Среднее значение различия между группами препарата Катиоланс® и раствора латанопроста, содержащего консервант, на пиковом и минимальном уровнях составляло -0.6 (95% ДИ -1.2, -0.1) и -0.5 (95% ДИ -1.0, 0.1), соответственно.
Изменение от исходного уровня в оценке окрашивания роговицы с использованием флуоресцеина (индекс CFS) на 12-й неделе у пациентов с исходным значением CFS ≥1 по модифицированной Оксфордской шкале было оценено как ключевой вторичный показатель эффективности. Препарат Катиоланс® продемонстрировал превосходство по сравнению с контрольной группой по улучшению показателя CFS на 12-й неделе.
Таблица 1. Результаты эффективности: Смешанная модель для повторных измерений по наблюдаемым случаям (исследуемый глаз, полный анализируемый набор данных)
| Конечный показатель (оценка на 12-й неделе) | Исход | Препарат Катиоланс® (N=192) | Раствор латанопроста с консервантом (N=192) |
| Основной конечный показатель Изменение ВГД от исходного уровня | Оценка в 9.00 ч | ||
| N | 188 | 189 | |
| Предел среднего (SE) | -8.8 (0.25) | -8.2 (0.26) | |
| 95% ДИ различия | -1.2, -0.1 | ||
| Оценка в 16.00 ч | |||
| N | 186 | 188 | |
| Предел среднего (SE) | -8.6 (0.24) | -8.1 (0.25) | |
| 95% ДИ различия | -1.0, 0.1 | ||
| Ключевой вторичный показатель Изменение индекса CFS от исходного уровня у пациентов с исходным значением CFS ≥1 | N | 80 | 86 |
| Предел среднего (SE) | -0.71 (0.069 | -0.41 (0.077) | |
| 95% ДИ различия | -0.46, -0.13 | ||
| Значение P | 0.0006 |
CFS - окрашивание роговицы флюоресцентном; ДИ - доверительный интервал; FAS - полный анализируемый набор данных; n - количество пациентов; LS среднее - среднее значение методом наименьших квадратов; MMRM - смешанная модель для повторных измерений; SE - стандартная ошибка.
Анализ применим ко всем пациентам из популяции полного анализа с исходным значением CFS ≥1 в отношении результатов теста CFS. Статистическая значимость (P<0.05) выделена жирным шрифтом.
Результаты эффективности: Изменение среднего исходного значения ВГД со стандартной ошибкой (SE) по визитам и временным точкам анализа (исследование глаза, открытая популяция)
Дети
Исследования эмульсии глазных капель Катиоланс® у детей не проводились.
Эффективность и безопасность раствора глазных капель латанопроста с консервантом были изучены у детей. Эффективность латанопроста у детей в возрасте до 18 лет была продемонстрирована в 12-недельном двойном слепом клиническом исследовании латанопроста в сравнении с тимололом у 107 пациентов с внутриглазной гипертензией и детской глаукомой. Гестационный возраст новорожденных должен был быть не менее 36 недель. Пациенты получали либо латанопрост 50 мкг/мл 1 раз/сут, либо тимолол 0.5% (или 0.25% для детей младше 3 лет) 2 раза/сут. Первичной конечной точкой оценки эффективности было среднее снижение ВГД относительно исходного уровня через 12 недель лечения.
Среднее снижение ВГД в группах латанопроста и тимолола было аналогичным. Во всех исследованных возрастных группах (от 0 до <3 лет, от 3 до <12 лет и от 12 до 18 лет) среднее снижение ВГД на 12-й неделе в группе латанопроста было аналогичным таковому в группе тимолола. Тем не менее данные об эффективности латанопроста в возрастной группе от 0 до 3 лет были получены только у 13 пациентов, получавших латанопрост, а у 4 пациентов в возрастной группе от 0 до 1 года соответствующая эффективность подтверждена не была. Данные о применении препарата у недоношенных детей (гестационный возраст <36 недель) отсутствуют.
Снижение ВГД у пациентов в подгруппе первичной врожденной глаукомы (ПВГ) было схожим в группе латанопроста и группе тимолола. В подгруппе пациентов без ПВГ (например, ювенильная открытоугольная глаукома, афакическая глаукома) получены такие же результаты, как и в подгруппе пациентов с ПВГ.
Влияние на ВГД наблюдалось после первой недели лечения (см. Таблицу 2) и сохранялось на протяжении 12-недельного периода исследования, как и у взрослых.
Таблица 2. Снижение ВГД (мм рт.ст.) на 12-й неделе в зависимости от группы активного лечения и исходного диагноза
| Латанопрост N=53 | Тимолол N=54 | |||
| Исходное среднее (SE) | 27.3 (0.75) | 27.8 (0.84) | ||
| Среднее изменение на 12-й неделе относительно исходного уровня* (SE) | -7.18 (0.81) | -5.72 (0.81) | ||
| Р-значение по сравнению с тимололом | 0.2056 | |||
| ПВГ N=28 | Без ПВГ N=25 | ПВГ N=26 | Без ПВГ N=28 | |
| Исходное среднее (SE) | 26.5 (0.72) | 28.2 (1.37) | 26.3 (0.95) | 29.1 (1.33) |
| Среднее изменение на 12 неделе относительно исходного уровня f(SE) | -5.90 (0.98) | -8.66 (1.25) | -5.34 (1.02) | -6.02 (1.18) |
| Р-значение по сравнению с тимололом | 0.6957 | 0.1317 | ||
SE - стандартная ошибка.
* скорректированная оценка, основанная на модели ковариационного анализа (ANCOVA).
Данные доклинической безопасности
Офтальмологическая и системная токсичность латанопроста исследовалась на нескольких видах животных. Как правило, латанопрост хорошо переносится с запасом безопасности не менее 1000 раз между терапевтической дозой препарата для инстилляции в глаз и системной токсичностью. Высокие дозы латанопроста, примерно в 100 раз превышающие терапевтическую дозу/кг массы тела, вводимые в/в обезьянам без обезболивания, увеличивают частоту дыхания, вероятно, отражая кратковременный бронхоспазм. В исследованиях на животных не было обнаружено сенсибилизирующих свойств латанопроста.
При введении латанопроста в дозах до 100 мкг/глаз/сут в глаза кроликов или обезьян не было выявлено токсического воздействия на глаза (терапевтическая доза составляет приблизительно 1.5 мкг/глаз/сут). Однако у обезьян латанопрост вызывал усиление пигментации радужной оболочки. Механизм усиления пигментации, по-видимому, заключается в стимуляции выработки меланина в меланоцитах радужки без каких-либо пролиферативных изменений. Изменение цвета радужной оболочки может быть постоянным.
В исследованиях хронической офтальмологической токсичности введение латанопроста в дозе 6 мкг/глаз/сут вызывало увеличение глазной щели. Этот эффект был обратим и развивался при введении препарата в дозах, превышающих терапевтические. Данный эффект у человека не наблюдался.
В 28-дневном исследовании офтальмологической токсичности введение препарата Катиоланс® 2 раза/сут в течение 28 дней не выявило местных или системных токсических эффектов у кроликов. Плазменные концентрации латанопростовой кислоты были незначительными через 15 минут после последней инстилляции препарата Катиоланс®.
В тестах на обратные мутации у бактерий, в тесте на мутации гена на клетках мышиной лимфомы и микроядерном тесте на мышах не было выявлено генотоксичности латанопроста. Хромосомные аберрации наблюдались в исследовании in vitro с лимфоцитами человека. Подобные эффекты отмечали с простагландином F2α, естественно продуцируемым простагландином, что свидетельствует о том, что это класс-специфический эффект.
В дополнительных исследованиях мутагенности для оценки репаративного синтеза ДНК in vitro/in vivo у крыс получен отрицательный результат, что указывает на отсутствие у латанопроста мутагенной активности. Исследования канцерогенности на мышах и крысах не выявили канцерогенного потенциала препарата.
В исследованиях на животных не было обнаружено влияния латанопроста на мужскую или женскую фертильность. В исследовании эмбриотоксичности на крысах не наблюдалось эмбриотоксичности при в/в введении латанопроста в дозах 5, 50 и 250 мкг/кг/сут. Однако у кроликов латанопрост вызывал гибель эмбрионов в дозах 5 мкг/кг/сут и выше.
Латанопрост в дозе 5 мкг/кг/сут (примерно в 100 раз выше клинической дозы) вызывал выраженную эмбриофетальную токсичность, характеризующуюся повышением частоты поздней резорбции и абортов, а также снижением массы плодов.
Тератогенный потенциал не обнаружен.
Фармакокинетика
Латанопрост (молекулярная масса 432.58) представляет собой пролекарство, этерифицированное изопропиловой группой, которое само по себе неактивно, но после гидролиза до кислотной формы становится биологически активным.
Всасывание
Пролекарство хорошо всасывается через роговицу и полностью гидролизуется при попадании во внутриглазную жидкость.
Распределение
Исследования латанопроста у человека показывают, что Cmax во внутриглазной жидкости достигается через 2 ч после местного применения. После местного применения у обезьян латанопрост распределяется преимущественно в передней камере глаза, конъюнктиве и веках. Лишь небольшое количество латанопроста достигает задней камеры глаза.
Метаболизм и выведение
Кислотная форма латанопроста практически не метаболизируется в глазу. Основной метаболизм препарата происходит в печени. Т1/2 из плазмы человека составляет 17 минут. Исследования на животных показали, что основные метаболиты (1,2-динор- и 1,2,3,4-тетранорметаболиты) не обладают (или обладают низкой) биологической активностью и выводятся преимущественно почками.
Дети
Открытое фармакокинетическое исследование концентраций латанопростовой кислоты в плазме было проведено у 22 взрослых и 25 детей (в возрасте 0-18 лет) с внутриглазной гипертензией и глаукомой. Пациенты всех возрастных групп получали латанопрост в дозе 50 мкг/мл по одной капле в каждый глаз в течение не менее 2 недель. Системная экспозиция латанопростовой кислоты была приблизительно в 2 раза выше у детей в возрасте от 3 до 12 лет и в 6 раз выше у детей в возрасте младше 3 лет по сравнению с взрослыми пациентами; при этом широкий диапазон безопасности в отношении возникновения системных нежелательных эффектов сохранялся (см. раздел "Передозировка"). Среднее время до достижения Cmax в плазме крови составляло 5 минут после инстилляции препарата во всех возрастных группах. Средний Т1/2 из плазмы была короткий (<20 минут), схожий у детей и взрослых, предупреждая кумуляцию латанопроста в кислотной форме в плазме крови в равновесной концентрации.
Показания препарата Катиоланс®
- снижение повышенного внутриглазного давления у взрослых пациентов с открытоугольной глаукомой и офтальмогипертензией;
- снижение повышенного внутриглазного давления и лечения глаукомы детского возраста у детей и подростков в возрасте от 4 до 18 лет.
| Код МКБ-10 | Показание |
| H40.0 | Подозрение на глаукому (глазная гипертензия) |
| H40.1 | Первичная открытоугольная глаукома |
Режим дозирования
Рекомендуемая доза – по 1 капле в пораженный(е) глаз (глаза) 1 раз/сут. Оптимальный эффект достигается при применении препарата Катиоланс® вечером.
Препарат не следует применять чаще 1 раз/сут, поскольку более частое введение снижает гипотензивный эффект.
При пропуске одной дозы лечение следует продолжать со следующей дозы по обычной схеме.
Дети
Дети от 0 до 4 лет
Безопасность и эффективность препарата Катиоланс® у детей в возрасте от 0 до 4 лет не установлены. Имеющиеся на данный момент данные приведены в разделах "Фармакологическое действие", "Фармакокинетика" и "Побочное действие", однако рекомендаций по режиму дозирования дать невозможно.
Дети от 4 до 18 лет
Режим дозирования для детей и подростков в возрасте от 4 до 18 лет такой же, как и для взрослых.
Способ применения
Местно, в виде инстилляций в конъюнктивальную полость.
Только для однократного применения.
Тюбик-капельница содержит достаточное количество препарата для инстилляции в оба глаза.
Как при применении любых других глазных капель, с целью снижения возможной системной абсорбции препарата после инстилляции каждой капли рекомендуется сдавливать слезный мешок у медиального угла глазной щели (окклюзия слезной точки) в течение одной минуты. Эту процедуру необходимо выполнять немедленно после инстилляции каждой капли.
Перед инстилляцией препарата необходимо снять контактные линзы и установить их не раньше, чем через 15 мин после введения.
Если применяется более одного местного офтальмологического препарата, лекарственные средства должны вводиться с интервалом не менее 5 минут. Препарат Катиоланс® следует вводить последним.
Препарат Катиоланс® представляет собой стерильную эмульсию белого цвета. Содержимое одной индивидуальной тюбик-капельницы следует применить сразу же после ее открытия для введения в пораженный(е) глаз(а). Поскольку после вскрытия индивидуальной тюбик-капельницы стерильность препарата уже нарушена, любое оставшееся содержимое необходимо выбросить сразу после введения.
Инструкция по медицинскому применению лекарственного препарата Катиоланс®
- Необходимо вымыть руки и удобно сесть или встать.
- Открыть алюминиевый пакет, который содержит 5 тюбик-капельниц для однократного применения.
- Извлечь одну тюбик-капельницу для однократного применения из алюминиевого пакета, оставив остальные тюбик-капельницы в пакете.
- Аккуратно встряхнуть тюбик-капельницу.
- Открутить колпачок (рисунок 1).
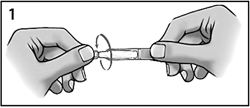
- Аккуратно оттянуть пальцем нижнее веко пораженного глаза (рисунок 2).
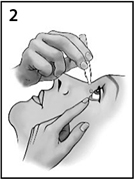
- Откинуть голову назад и посмотреть на потолок.
- Поднести кончик тюбик-капельницы близко к глазу, не следует касаться глаза кончиком тюбик-капельницы.
- Аккуратно выдавить одну каплю препарата в глаз, затем отпустить нижнее веко.
- Моргнуть несколько раз, чтобы препарат распределился по всему глазу.
- После применения препарата Катиоланс® следует слегка надавить пальцем на внутренний угол пораженного глаза у носа. Удерживать палец в течение 1 минуты, закрыв глаза (рисунок 3). В этом месте находится небольшой проток, по которому слезы отводятся от глаз к носу. Нажатие на эту точку закрывает отверстие этого дренажного канала. Это помогает предотвратить попадание препарата Катиоланс® в общий кровоток.
- Если по назначению врача пациент использует препарат в оба глаза, следует повторить этапы 6-11 и для другого глаза.
- Выбросить тюбик-капельницу для однократного применения после применения. Не хранить ее для повторного применения.
Побочное действие
Резюме профиля безопасности
Большинство нежелательных реакций (НР) отмечались со стороны органа зрения. В открытом 5-летнем исследовании безопасности раствора глазных капель латанопроста у 33% пациентов развилась пигментация радужной оболочки (см. раздел "Особые указания"). Прочие НР со стороны органа зрения, как правило, были кратковременными и наблюдались непосредственно во время введения препарата.
Данные по безопасности препарата Катиоланс® были получены в ходе исследования с участием 330 пациентов. Наиболее распространенными НР были гиперемия глаз (1.6%) и конъюнктивальная инъекция (1.0%). Серьезных НР, специфичных для препарата Катиоланс®, в ходе исследований не выявлено.
Данные о безопасности длительного применения препарата Катиоланс® были получены в ходе исследования фазы III, проведенного в течение 360 дней с участием 118 пациентов. Профиль безопасности длительного применения не отличался от профиля, наблюдавшегося в первые 3 месяца лечения. Наиболее частыми НР со стороны глаз, зарегистрированными при длительном применении, были гиперемия глаз и конъюнктивальная инъекция (4.4%), аномальные ощущения в глазах (2.2%) и рост ресниц (2.2%).
Табличное резюме нежелательных реакций
В таблице 1 представлены НР на глазные капли латанопроста (раствор с консервантом), выявленные в ходе клинических исследований и пострегистрационных наблюдений. НР, наблюдавшиеся с иной частотой в ходе клинических исследований глазных капель-эмульсии Катиоланс®, обозначены в Таблице 3 цифрой "2".
НР классифицируются по частоте следующим образом: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Таблица 3
| Очень часто (≥1/10) | Часто (от ≥1/100 до <1/10) | Нечасто (от ≥1/1000 до <1/100 | Редко (от ≥1/10000 до <1/1000) | Очень редко (<1/10000) |
| Инфекции и инвазии | ||||
| Герпетический кератит1 | ||||
| Со стороны нервной системы | ||||
| Головная боль1, головокружение1 | ||||
| Со стороны органа зрения | ||||
| Гиперпигментация радужной оболочки | Конъюнктивальная инъекция2 легкой или средней степени тяжести, раздражение глаз (жжение, ощущение песка в глазах, зуд, покалывание и ощущение инородного тела и аномальное ощущение)2; точечный кератит (преимущественно бессимптомный), боль в глазу, фотофобия, конъюнктивит1 | Отек век2, изменения ресниц и пушковых волос век (увеличение длины, толщины, пигментации и количества ресниц)2; блефарит2, сухость глаз, кератит1, затуманенное зрение 2; отек макулы, в т.ч. кистозный отек макулы1; увеит1 | Ирит1, отек роговицы1, эрозия роговицы; периорбитальный отек, трихиаз1, дистихиаз; киста радужной оболочки1; локализованная реакция со стороны кожи век; потемнение кожи век; псевдопемфигоид конъюнктивы глаза1 | Изменения в периорбитальной области и в области век, приводящие к углублению борозды верхнего века |
| Со стороны сердца | ||||
| Стенокардия, ощущение сердцебиения | Нестабильная стенокардия | |||
| Со стороны дыхательной системы, органов грудной клетки и средостения | ||||
| Астма1; диспноэ1 | Обострение астмы | |||
| Со стороны ЖКТ | ||||
| Тошнота1, рвота1 | ||||
| Со стороны кожи и подкожных тканей | ||||
| Сыпь | Зуд | |||
| Со стороны мышечной, скелетной и соединительной ткани | ||||
| Миалгия1, артралгия1 | ||||
| Общие нарушения и реакции в месте введения | ||||
| Боль в груди1 | ||||
1 НР была выявлена в постмаркетинговом периоде.
2 Частота НР оценивалась по результатам исследований эмульсии глазных капель препарата Катиоланс®.
Дети
В двух краткосрочных клинических исследованиях (≤12 недель) с участием 93 (25 и 68) детей, получавших раствор глазных капель латанопроста, содержащего консервант, профиль безопасности был аналогичен таковому у взрослых, и новых НР выявлено не было.
Краткосрочные профили безопасности в различных подгруппах детей также были схожими (см. разделы "Фармакологическое действие" и "Режим дозирования"). НР, которые наблюдались чаще при применении латанопроста с консервантом у детей по сравнению со взрослыми, включали назофарингит и лихорадку.
Специальные исследования препарата Катиоланс® у детей не проводились.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск" лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальную систему сообщения о нежелательных реакциях государств-членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к латанопросту или к любому из вспомогательных веществ, входящих в состав препарата.
Применение при беременности и кормлении грудью
Беременность
Безопасность применения этого лекарственного препарата во время беременности у человека не установлена. Препарат Катиоланс® может оказывать потенциально опасные фармакологические эффекты на течение беременности, плод или новорожденного.
Поэтому препарат Катиоланс® не следует применять во время беременности, а также у женщин с детородным потенциалом, не использующих контрацепцию.
Период грудного вскармливания
Латанопрост и его метаболиты могут проникать в грудное молоко. Поэтому препарат Катиоланс® не следует применять в период грудного вскармливания или грудное вскармливание следует прекратить.
Фертильность
В исследованиях на животных не было обнаружено влияния препарата Катиоланс® на мужскую или женскую фертильность (см. подраздел "Данные доклинической безопасности").
Применение у детей
Особые указания
Изменение цвета глаз
Препарат Катиоланс® может постепенно изменить цвет глаз за счет увеличения содержания коричневого пигмента в радужной оболочке. Перед началом лечения пациентов необходимо проинформировать о возможном необратимом изменении цвета глаз. Лечение только одного глаза может вызвать необратимую гетерохромию.
Такое изменение цвета глаз чаще наблюдалось при применении латанопроста у пациентов со смешанной окраской радужки, а именно: сине-коричневой, серо-коричневой, желто-коричневой и зелено-коричневой. В исследованиях латанопроста изменение цвета радужки обычно наступало в течение первых 8 месяцев лечения, редко - в течение второго или третьего года и не наблюдали после четвертого года лечения. Скорость прогрессирования пигментации радужной оболочки со временем уменьшается и стабилизируется в течение пяти лет. Эффект усиления пигментации по прошествии пяти лет не оценивался. В открытом 5-летнем исследовании безопасности латанопроста у 33% пациентов развилась пигментация радужной оболочки (см. раздел "Побочное действие"). Изменение цвета радужки в большинстве случаев было незначительным и часто клинически не выявлялось. Частота возникновения изменения цвета радужки у пациентов с радужной оболочкой разного цвета колеблется от 7 до 85%, преобладая у пациентов с желто-коричневой радужкой. У пациентов с однородно голубыми глазами никаких изменений не наблюдалось, а у пациентов с однородно серыми, зелеными или карими глазами изменения наблюдались редко.
Изменение цвета глаз при лечении латанопростом обусловлено увеличением содержания меланина в стромальных меланоцитах радужки, а не увеличением количества меланоцитов. Как правило, коричневая пигментация вокруг зрачка распространяется концентрически к периферии пораженных глаз, но вся радужная оболочка или ее части могут стать более коричневатыми. После прекращения лечения латанопростом дальнейшего усиления коричневого пигмента радужной оболочки не наблюдалось. По имеющимся на сегодняшний день клиническим данным, изменение цвета не было связано с какими-либо симптомами или патологическими нарушениями.
Лечение латанопростом не оказывало влияния ни на невусы, ни на пигментные пятна радужной оболочки. Накопления пигмента в трабекулярной сети или иных отделах передней камеры глаза в клинических исследованиях не наблюдалось. Согласно результатам 5-летних клинических исследований латанопроста, усиление пигментации радужки не приводит к негативным клиническим последствиям, поэтому при развитии пигментации радужной оболочки применение препарата Катиоланс® можно продолжать. Тем не менее, такие пациенты должны находиться под регулярным наблюдением, и, если этого требует клиническая ситуация, лечение препаратом Катиоланс® может быть прекращено.
Хроническая закрытоугольная глаукома
Опыт применения латанопроста при хронической закрытоугольной глаукоме и открытоугольной глаукоме у пациентов с псевдофакией и пигментной глаукомой ограничен. Опыт применения латанопроста при лечении воспалительной и неоваскулярной глаукомы или воспалительных заболеваний глаз отсутствует. Латанопрост не влияет или оказывает незначительное влияние на величину зрачка, но опыта применения при острых приступах закрытоугольной глаукомы нет. Поэтому следует с осторожностью применять препарат Катиоланс® у таких пациентов.
Операция по удалению катаракты
В связи с тем, что сведения о применении латанопроста в послеоперационном периоде экстракции катаракты ограничены, следует соблюдать осторожность при применении препарата Катиоланс® у этих пациентов.
Пациенты с герпетическим кератитом, афакией, псевдофакией в анамнезе
Следует соблюдать осторожность при применении препарата Катиоланс® у пациентов с герпетическим кератитом в анамнезе, и его следует избегать в случаях активного герпетического кератита и у пациентов с рецидивирующим герпетическим кератитом в анамнезе, особенно связанного с применением аналогов простагландина.
Макулярный отек и кистозный макулярный отек
О случаях макулярного отека при применении латанопроста сообщалось (см. раздел "Побочное действие") преимущественно у пациентов с афакией, псевдофакией, разрывом задней капсулы хрусталика или интраокулярными линзами, имплантированными в переднюю камеру глаза, а также у пациентов с факторами риска развития кистозного макулярного отека (таких как, диабетическая ретинопатия и окклюзия вен сетчатки). Препарат Катиоланс® следует применять с осторожностью у пациентов с афакией, псевдофакией, разрывом задней капсулы хрусталика или интраокулярными линзами, имплантированными в переднюю камеру глаза, а также у пациентов с известными факторами риска кистозного макулярного отека.
Ирит/увеит
Препарат Катиоланс® следует применять с осторожностью у пациентов с известными предрасполагающими факторами риска развития ирита/увеита.
Пациенты с бронхиальной астмой
Опыт применения латанопроста у пациентов с бронхиальной астмой ограничен, но о некоторых случаях обострения астмы и/или диспноэ при применении латанопроста сообщалось в постмаркетинговом периоде. Поэтому, латанопрост у пациентов с астмой следует применять с осторожностью, пока не будет накоплен достаточный клинический опыт (см. также раздел "Побочное действие").
Изменение цвета кожи периорбитальной области
При применении латанопроста наблюдалось изменение цвета кожи в периорбитальной области, причем большинство сообщений было получено от пациентов из Японии. Имеющийся на сегодняшний день опыт показывает, что изменение цвета кожи периорбитальной области носит обратимый характер, а в некоторых случаях исчезает на фоне продолжения лечения латанопростом.
Изменения ресниц
Латанопрост может вызывать постепенные изменения ресниц и пушковых волос в обработанном глазу и вокруг него, включая увеличение длины, толщины, усиление пигментации, увеличение количества ресниц или волос и изменение направления роста ресниц. Изменения ресниц обратимы после прекращения лечения латанопростом.
Другое
Не рекомендуется одновременно применять латанопрост с простагландинами, аналогами простагландинов или производными простагландинов (см. раздел "Лекарственное взаимодействие").
Вспомогательные вещества
В состав препарата Катиоланс® входит цеталкония хлорид, который может вызывать раздражение глаз.
Учитывая возможное влияние цеталкония хлорида на контактные линзы при применении глазных капель перед сном следует снимать контактные линзы и повторно надевать их после пробуждения.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Катиоланс® оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами.
Как и при применении других офтальмологических препаратов, возможно временное затуманивание зрения после инстилляции препарата Катиоланс®. До восстановления четкости зрения управлять транспортными средствами или работать с механизмами не рекомендуется.
Передозировка
Передозировка при закапывании препарата в глаз маловероятна. В случае возникновения передозировки при применении препарата Катиоланс® лечение должно быть симптоматическим.
Симптомы: помимо раздражения глаз и конъюнктивальной инъекции, другие нежелательные реакции со стороны глаз при передозировке латанопростом при закапывании в глаза неизвестны.
Лечение: симптоматическая терапия.
Дети
Описанные выше принципы применимы к лечению передозировки у детей.
Лекарственное взаимодействие
Исследования взаимодействия у взрослых пациентов не проводились.
Сообщалось о парадоксальном повышении ВГД после одновременного офтальмологического введения двух аналогов простагландина. Поэтому одновременное офтальмологическое применение двух и более простагландинов, аналогов простагландинов или производных простагландинов не рекомендуется.
Дети
Исследований взаимодействия у детей не проводилось.
Условия хранения препарата Катиоланс®
Препарат следует хранить при температуре не выше 25°С.
Срок годности препарата Катиоланс®
После первого вскрытия пакета из ламинированной алюминиевой фольги использовать в течение 28 дней; хранить в оригинальной упаковке (пакете из ламинированной алюминиевой фольги) для защиты от света и испарения.
Условия реализации
Контакты для обращений
САНТЭН ООО (Россия)

|
|
105064 Москва, |
X



