Газива® (Gazyva®) инструкция по применению
- 📜 Инструкция по применению Газива®
- 💊 Состав препарата Газива®
- ✅ Применение препарата Газива®
- 📅 Условия хранения Газива®
- ⏳ Срок годности Газива®
Владелец регистрационного удостоверения:
Упаковка и выпускающий контроль качества:
F.Hoffmann-La Roche, Ltd (Швейцария) или ФАРМСТАНДАРТ-УфаВИТА, ОАО (Россия)
Лекарственная форма
|
|
Газива® |
Концентрат для приготовления раствора для инфузий 1000 мг/40 мл: фл. 1 шт.
рег. №: ЛП-(001150)-(РГ-RU)
от 23.08.22
- Бессрочно
Дата переоформления: 22.08.25
Предыдущий рег. №: ЛП-002867
|
Форма выпуска, упаковка и состав препарата Газива®
Концентрат для приготовления раствора для инфузий в виде прозрачной или опалесцирующей жидкости от бесцветного до слегка коричневатого цвета.
| 1 мл | 1 фл. | |
| обинутузумаб | 25 мг | 1000 мг |
Вспомогательные вещества: L-гистидин, L-гистидина гидрохлорида моногидрат, α,α-трегалозы дигидрат, полоксамер 188, вода д/и.
40 мл - флаконы бесцветного стекла (1) - пачки картонные×.
40 мл - флаконы бесцветного стекла (1) - поддоны пластиковые (1) - пачки картонные××.
40 мл - флаконы бесцветного стекла (1) - вкладыши картонные (1) - пачки картонные××.
× С целью контроля первого вскрытия на пачку наносится защитная голографическая наклейка.
×× C целью контроля первого вскрытия на пачку наклеивают самоклеящиеся стикеры с надписью "контроль вскрытия" (в случае упаковки на ОАО "Фармстандарт-УфаВИТА").
Фармакологическое действие
Механизм действия
Обинутузумаб представляет собой рекомбинантное, гуманизированное, моноклональное антитело II типа с модифицированной схемой гликозилирования, принадлежащее к классу IgG1 и обладающее специфичностью к антигену CD20. Обинутузумаб избирательно взаимодействует с внеклеточным участком трансмембранного антигена CD20, расположенного на поверхности нормальных и злокачественных зрелых В-лимфоцитов и их предшественников, при этом не связывается со стволовыми гемопоэтическими клетками, про-В-лимфоцитами, плазматическими клетками, а также другими нормальными тканями.
Благодаря модификации схемы гликозилирования Fc-фрагмента обинутузумаб обладает повышенным сродством к рецепторам FcγRIII на поверхности эффекторных клеток иммунной системы, в частности натуральных киллеров, макрофагов и моноцитов, по сравнению с антителами, не прошедшими такую модификацию.
В доклинических исследованиях обинутузумаб напрямую индуцирует гибель клеток, опосредует антитело-зависимую клеточную цитотоксичность (АЗКЦ) и антитело-зависимый клеточный фагоцитоз (АЗКФ) путем привлечения FcγRIII-положительных эффекторных клеток иммунной системы. Кроме того, обинутузумаб в низкой степени индуцирует комплемент-зависимую цитотоксичность (КЗЦ). На моделях у животных применение обинутузумаба приводит к значительному угнетению В-клеток и противоопухолевой эффективности. По сравнению с анти-CD20 антителами I типа обинутузумаб (антитело II типа) обладает повышенной способностью к прямой индукции гибели клеток на фоне пониженной способности вызывать КЗЦ. Благодаря модификации схемы гликозилирования обинутузумаб более эффективно индуцирует АЗКЦ и АЗКФ по сравнению с анти-CD20 антителами, не прошедшими такую модификацию. Это проявляется в более выраженном истощении пула B-клеток в крови и вторичных лимфоидных органах, а также в повышенной противоопухолевой активности на некоторых моделях у животных по сравнению с анти-CD20 антителами I типа. Также по сравнению с антителами I типа к CD20 препарат Газива® более эффективно подавлял CD19+ B-клетки в селезенке и способствовал улучшению показателей такого заболевания, как гломерулонефрит, в моделях подтвержденного волчаночного поражения у животных.
Фармакодинамические эффекты
В опорном клиническом исследовании BO21004/CLL11 истощение пула CD19+ B-клеток (до значений < 0.07х109/л) наблюдалось у 91% (40 из 44) пациентов с ХЛЛ после завершения терапии обинутузумабом в комбинации с хлорамбуцилом и сохранялось в первые 6 месяцев в период последующего наблюдения.
Восстановление числа B-клеток происходило в течение 12-18 месяцев в период последующего наблюдения у 35% (14 из 40) пациентов при отсутствии прогрессирования и у 13% (5 из 40) пациентов с прогрессированием заболевания.
В опорном клиническом исследовании у пациентов с иНХЛ (GAO4753/GADOLIN) у 97% (171 из 176) оцениваемых пациентов, получающих препарат Газива®, отмечалось истощение пула B-клеток в конце терапии, а у 97% (61 из 63) пациентов истощение сохранялось более 6 месяцев после введения последней дозы. Восстановление числа B-клеток наблюдалось в
течение 12–18 месяцев в период последующего наблюдения у 11% (5 из 46) оцениваемых пациентов.
В опорном клиническом исследовании у пациентов с ВН (CA41705/REGENCY), у 99.2% пациентов, получавших лечение препаратом Газива, общие уровни CD19+ B-клеток в периферической крови достигли значений ниже установленного порога (10 клеток/мкл) к неделе 4 после начала лечения и сохранялись на уровне ниже этого порога у 95% пациентов к
неделе 76.
Число циркулирующих неактивированных В-клеток и В-клеток памяти, а также плазмобластов/плазматических клеток снижалось к неделе 4 и оставалось низким до недели 76 после начала лечения.
По сравнению с плацебо лечение препаратом Газива® приводило к улучшениям со стороны компонентов комплемента (C3 и C4) к неделе 4, а также со стороны антител к двухцепочечной ДНК (дцДНК) к неделе 12; эти изменения сохранялись до недели 76.
У пациентов с низким исходным уровнем С3 нормализация этого показателя была достигнута в 49% случаев к неделе 12 и в 62% случаев к неделе 76 в группе препарата Газива®, по сравнению с 33% и 29% в группе плацебо. У пациентов с низким исходным уровнем С4 нормализация этого показателя была достигнута в 75% случаев к неделе 12 и в 88% случаев к неделе 76 в группе препарата Газива®, по сравнению с 55% к неделе 12 и 55% к неделе 76 в группе плацебо. Среди пациентов с положительным результатом анализа на антитела к дцДНК на исходном уровне сероконверсия отмечалась у 32% и 56% пациентов к неделе 4 и неделе 76 в группе препарата Газива® по сравнению с 16% и 16% в группе плацебо.
Клиническая значимость описанных выше фармакодинамических маркеров не была установлена.
Клиническая эффективность и безопасность
Хронический лимфолейкоз
Было проведено международное многоцентровое открытое рандомизированное двухэтапное клиническое исследование III фазы в трех группах (BO21004/CLL11), направленное на изучение профиля безопасности и эффективности комбинации препарата Газива® и хлорамбуцила в сравнении с комбинацией ритуксимаба и хлорамбуцила или монотерапией хлорамбуцилом. В исследование были включены пациенты с ранее нелеченным ХЛЛ и наличием сопутствующих заболеваний.
Критериями включения пациентов являлись документально подтвержденный ХЛЛ CD20+ и один из двух или оба следующих показателя наличия сопутствующих заболеваний: показатель более 6 баллов по шкале оценки коморбидности (CIRS) или снижение функции почек (КК < 70 мл/мин). Пациенты с нарушением функций печени (Национальный институт рака, критерии
стандартной терминологии нежелательных явлений для отклонений в печеночных пробах 3-й степени тяжести (АСТ, АЛТ >5 × ВГН в течение >2 недель; билирубин >3 × ВГН) и почек (КК < 30 мл/мин) в исследование не включались.
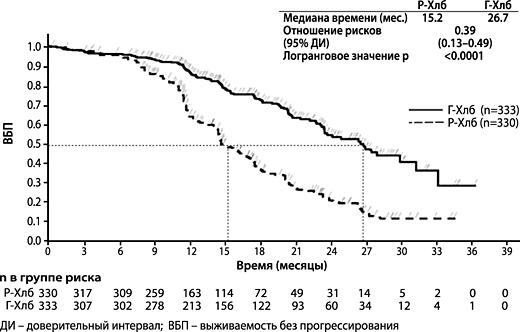
781 пациент был рандомизирован в соотношении 2:2:1 в группы получения комбинации препарата Газива® и хлорамбуцила, комбинации ритуксимаба и хлорамбуцила и монотерапии хлорамбуцилом. На этапе 1 у 356 пациентов сравнивалась эффективность комбинации препарата Газива® и хлорамбуцила с эффективностью монотерапии хлорамбуцилом, а на этапе 2 у 663 пациентов сравнивалась эффективность комбинации препарата Газива® и хлорамбуцила с эффективностью комбинации ритуксимаба и хлорамбуцила. Результаты оценки эффективности приведены в таблице 1 и на рисунках 1-3.
Большинству пациентов препарат Газива® вводили в/в в первоначальной дозе 1000 мг в день 1, день 8 и день 15 первого цикла лечения. Для снижения частоты развития ИР, 140 пациентам скорректировали дозу и вводили ее в течение 2 дней (день 1 [100 мг] и день 2 [900 мг]) (см. раздел "Режим дозирования"). В течение каждого последующего цикла лечения (циклы 2-6) пациенты получали препарат Газива® в дозе 1000 мг только в день 1. Хлорамбуцил вводили перорально в дозе 0.5 мг/кг массы тела в день 1 и день 15 всех циклов терапии (1-6).
Группы лечения были хорошо сбалансированы по демографическим данным и исходным характеристикам. Большинство пациентов были представителями европеоидной расы (95%) и мужского пола (61%). Средний возраст составил 73 года, при этом 44% пациентов были старше 75 лет. На исходном уровне у 22% пациентов была стадия A по Бине, у 42% - стадия B по Бине, а у 36% - стадия C по Бине.
Средний индекс коморбидности составил 8 баллов, а у 76% включенных пациентов индекс коморбидности был выше 6 баллов. Средний расчетный КК составил 62 мл/мин, а у 66% пациентов КК был < 70 мл/мин. У 42% включенных пациентов КК был < 70 мл/мин, а индекс коморбидности был > 6. 34% пациентов были включены только по статусу коморбидности, а
23% — только по признаку нарушения функции почек.
Наиболее часто регистрируемыми сопутствующими заболеваниями (с использованием пограничного значения 30% или выше) в соответствии с системно-органной классификацией согласно MedDRA были: нарушения со стороны сосудов (73%), нарушения со стороны сердца (46%), желудочно-кишечные нарушения (38%), нарушения метаболизма и питания (40%), нарушения со стороны почек и мочевыводящих путей (38%), нарушения со стороны мышечной, скелетной и соединительной ткани (33%).
Первичной конечной точкой исследования была оценка исследователем выживаемости без прогрессирования (ВБП) заболевания. Кроме того, независимый экспертный комитет (НЭК) оценил всех пациентов на предмет прогрессирования, а также оценил ВБП (ВБП-НЭК).
Ключевыми вторичными конечными точками эффективности были скорость ответа на терапию в конце лечения, молекулярная ремиссия в конце лечения (статус минимального остаточного заболевания) и конечные точки времени до события (выживаемость без событий, новая терапия против лимфолейкоза). Общая выживаемость для стадии 1 представлена на рисунке 2. Общая выживаемость для стадии 2 еще отслеживается, данные еще не сформированы.
Таблица 1. Сводные результаты по показателям эффективности в исследовании BO21004/CLL11
| Этап 1 | Этап 2 | |||
| Хлорамбуцил N = 118 | Газива® + хлорамбуцил N = 238 | Ритуксимаб + хлорамбуцил N = 330 | Газива® + хлорамбуцил N = 333 | |
| Медиана времени наблюдения - 22.8 месяца | Медиана времени наблюдения -18.7 месяца | |||
| ВБП по оценке исследователя (ВБП-ИСС)a | ||||
| Количество (%) пациентов с явлением | 96 (81.4%) | 93 (39.1%) | 199 (60.3%) | 104 (31.2%) |
| Медиана времени до наступления события (месяцы) | 11.1 | 26.7 | 15.2 | 26.7 |
| Отношение рисков (95% ДИ) | 0.18 [0.13; 0.24] | 0.39 [0.31; 0.49] | ||
| p-значение (логранговый критерий, стратифицированныйb) | <0.0001 | <0.0001 | ||
| ВБП по оценке НЭК (ВБП-НЭК)a | ||||
| Количество (%) пациентов с явлением | 90 (76.3%) | 89 (37.4%) | 183 (55.5%) | 103 (30.9%) |
| Медиана времени до наступления события (месяцы) | 11.2 | 27.2 | 14.9 | 26.7 |
| Отношение рисков (95% ДИ) | 0.19 [0.14; 0.27] | 0.42 [0.33; 0.54] | ||
| p-значение (логранговый критерий, стратифицированныйb | <0.0001 | <0.0001 | ||
| Частота ответа в конце лечения | ||||
| Количество пациентов, включенных в анализ | 118 | 238 | 329 | 333 |
| Пациенты, ответившие на лечение (%) | 37 (31.4%) | 184 (77.3%) | 214 (65.0%) | 261 (78.4%) |
| Пациенты без ответа на терапию (%) | 81 (68.6%) | 54 (22.7%) | 115 (35.0%) | 72 (21.6%) |
| Различие в частоте ответа (95% ДИ) | 45.95 [35.6; 56.3] | 13.33 [6.4; 20.3] | ||
| p-значение (критерий хи-квадрат) | <0.0001 | <0.0001 | ||
| Число пациентов с полным ответомс (%) | 0 (0.0%) | 53 (22.3%) | 23 (7.0%) | 69 (20.7%) |
| Молекулярная ремиссия в конце леченияd | ||||
| Количество пациентов включенных в анализ | 90 | 168 | 244 | 239 |
| Отрицательный статус МОЗe (%) | 0 (0%) | 45 (26.8%) | 6 (2.5%) | 61 (25.5%) |
| Положительный статус МОЗf (%) | 90 (100%) | 123 (73.2%) | 238 (97.5%) | 178 (74.5%) |
| Различие в показателях МОЗ (95% ДИ) | 26.79 [19.5; 34.1] | 23.06 [17.0; 29.1] | ||
| Бессобытийная выживаемость | ||||
| Число (%) пациентов с событием | 103 (87.3%) | 104 (43.7%) | 208 (63.0%) | 118 (35.4%) |
| Медиана времени до наступления события (месяцы) | 10.8 | 26.1 | 14.3 | 26.1 |
| Отношение рисков (95% ДИ) | 0.19 [0.14; 0.25] | 0.43 [0.34; 0.54] | ||
| p-значение (логранговый критерий. стратифицированныйb) | <0.0001 | <0.0001 | ||
| Время до начала новой противолейкозной терапии | ||||
| Число (%) пациентов с событием | 65 (55.1%) | 51 (21.4%) | 86 (26.1%) | 55 (16.5%) |
| Медиана времени до наступления события (месяцы) | 14.8 | Н/Д | 30.8 | Н/Д |
| Отношение рисков (95% ДИ) | 0.24 [0.16; 0.35] | 0.59 [0.42; 0.82] | ||
| p-значение (логранговый критерий. стратифицированныйb) | <0.0001 | <0.0018 | ||
| Общая выживаемость | ||||
| Число (%) пациентов с событием | 24 (20.3%) | 22 (9.2%) | 41 (12.4%) | 28 (8.4%) |
| Медиана времени до наступления события (месяцы) | Н/Д | Н/Д | Н/Д** | Н/Д** |
| Отношение рисков (95% ДИ)) | 0.41 [0.23; 0.74] | 0.66 [0.41; 1.06]** | ||
| p-значение (логранговый критерий. стратифицированныйb) | 0.0022 | 0.0849** | ||
НЭК — независимый экспертный комитет; ВБП — выживаемость без прогрессирования; ОР — отношение рисков; ДИ — доверительный интервал, МОЗ — минимальное остаточное заболевание, Н/Д — не достигнуто.
a Определяется как время от момента рандомизации до первого наступления прогрессирования, рецидива или смерти от любой причины по оценке исследователя.
b На исходном уровне стратифицировано по стадиям Бине.
c Включает 11 пациентов в группе Газива + хлорамбуцил с полным ответом и с неполным восстановлением функции костного мозга.
d Кровь и костный мозг вместе.
e Отрицательный статус МОЗ определяется как результат ниже 0.0001.
f Включает пациентов с положительным статусом МОЗ и пациентов, у которых до завершения лечения были зафиксированы прогрессирование или летальный исход.
** Данные не зрелые.
Результаты анализа ВБП по подгруппам (т. е. по полу, возрасту, стадиям по Бине, КК, индексу коморбидности CIRS, бета-2-микроглобулину, статусу гена IGVH, наличию хромосомных аномалий, количеству лимфоцитов на исходном уровне) были сопоставимы с результатами общей популяции ITT. Риск прогрессирования заболевания или летального исхода в группе Газива® + хлорамбуцил был ниже по сравнению с группой ритуксимаб + хлорамбуцил и группой монотерапии хлорамбуцилом во всех подгруппах. Отношение рисков составило 0.08 в группе Газива® + хлорамбуцил по сравнению с 0.42 в группе монотерапии хлорамбуцилом и 0.28 в группе Газива® + хлорамбуцил по сравнению с 0.71 в группе ритуксимаб + хлорамбуцил.
Рисунок 1. Кривая Каплана-Мейера по ВБП по оценке исследователя на этапе 1
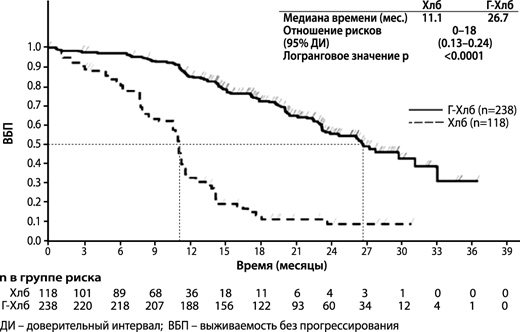
Рисунок 2. Кривая Каплана-Мейера по ОВ на этапе 1
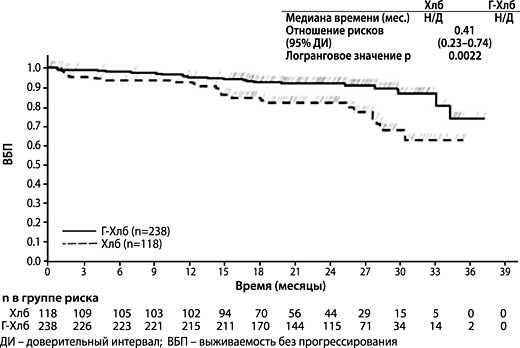
Рисунок 3. Кривая Каплана-Мейера по ВБП по оценке исследователя на этапе 2
Исходы, сообщаемые пациентами
Данные опросников QLQC30 и QLQ-CLL-16, которые заполнялись в рамках периода терапии, не выявили существенного различия ни по одной из субшкал. Данные, полученные во время последующего наблюдения, особенно для группы монотерапии хлорамбуцилом, ограничены. Тем не менее на сегодняшний день не обнаружено заметных различий в качестве жизни за время последующего наблюдения.
Оценка качества жизни, связанного со здоровьем, в отношении утомляемости на протяжении всего периода лечения не выявила статистически значимых различий, в связи с чем можно предполагать, что добавление препарата Газива® в схему лечения хлорамбуцилом не приводит к усилению утомляемости у пациентов.
Неходжкинская лимфома (фолликулярная лимфома)
Ранее нелеченная фолликулярная лимфома
В открытом многоцентровом рандомизированном клиническом исследовании III фазы (BO21223/GALLIUM) оценивали 1202 пациентов с ранее нелеченной ФЛ стадии II с высокой опухолевой нагрузкой, стадий III и IV). Пациенты были рандомизированы в соотношении 1:1 либо в группу терапии препаратом Газива®, либо в группу терапии ритуксимабом в комбинации с химиотерапией (CHOP, CVP или бендамустин) и последующей поддерживающей терапии с применением препарата Газива® или ритуксимаба у пациентов, достигших полного или частичного ответа.
Группы лечения были хорошо сбалансированы по демографическим данным и исходным характеристикам популяции пациентов; медиана возраста составила 59 лет. Большинство пациентов были представителями европеоидной расы (81%) и женского пола (53%). У 79% было ≥ 2 баллов по индексу FLIPI, при этом у 7% была II стадия заболевания (с высокой опухолевой нагрузкой), у 35% - III стадия и у 57% - IV стадия. 57% пациентов получали бендамустин, 33% получали химиотерапию по схеме CHOP, и 10% - по схеме CVP. 44% пациентов имели высокую опухолевую нагрузку (опухоль >7 см), у 34% присутствовал по меньшей мере один B-симптом на исходном уровне, а у 97% показатель общего состояния по шкале ECOG (Eastern Cooperative Oncology Group, Восточная объединенная онкологическая группа) на исходном уровне был равен 0 или 1.
Препарат Газива® (1000 мг) вводили в виде в/в инфузий (см. раздел "Режим дозирования") перед проведением химиотерапии. Бендамустин вводили в/в в дни 1 и 2 каждого цикла лечения (циклы 1-6) в дозе 90 мг/м2/сут в комбинации с препаратом Газива®. Терапия по схемам CHOP и CVP проводилась в стандартных дозах. После проведения 6-8 циклов терапии препаратом Газива® в комбинации с химиотерапией пациенты, ответившие на лечение, получали поддерживающую терапию препаратом Газива® каждые 2 месяца до прогрессирования заболевания или в течение 2 лет.
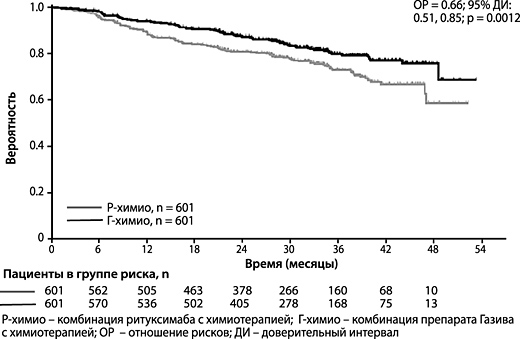
Результаты оценки эффективности представлены в таблице 2. Кривые Каплана-Мейера по ВБП показаны на рисунке 4.
Таблица 2. Сводные результаты по показателям эффективности у пациентов с ФЛ в исследовании BO21223 (GALLIUM)
| Ритуксимаб + химиотерапия с последующей поддерживающей терапией ритуксимабом N = 601 | Препарат Газива + химиотерапия с последующей поддерживающей терапией препаратом Газива N = 601 | |
| Медиана периода наблюдения = 34 месяца | Медиана периода наблюдения = 35 месяцев | |
| Первичная конечная точка | ||
| ВБП по оценке исследователя§ (ВБП-ИСС) | ||
| Количество (%) пациентов с явлением | 144 (24.0%) | 101 (16.8%) |
| ОР [95% ДИ] | 0.66 [0.51; 0.85] | |
| p-значение (логранговый критерий, стратифицированный*) | 0.0012 | |
| Расчетный показатель ВБП за 2 года [95% ДИ] | 80.9 [77.4; 84.0] | 87.7 [84.6; 90.1] |
| Расчетный показатель ВБП за 3 года [95% ДИ] | 73.3 [68.8; 77.2] | 80.0 [75.9; 83.6] |
| Ключевые конечные точки | ||
| ВБП по оценке НЭК§ (ВБП-НЭК) | ||
| Количество (%) пациентов с явлением | 125 (20.8%) | 93 (15.5%) |
| ОР [95% ДИ] | 0.71 [0.54; 0.93] | |
| p-значение (логранговый критерий. стратифицированный*) | 0.0138 | |
| Расчетный показатель ВБП за 2 года [95% ДИ] | 82.0 [78.5; 85.0] | 87.7 [84.6; 90.1] |
| Расчетный показатель ВБП за 3 года [95% ДИ] | 77.9 [73.8; 81.4] | 81.9 [77.9; 85.2] |
| Время до следующей противолимфомной терапии# | ||
| Количество (%) пациентов с явлением | 111 (18.5%) | 80 (13.3%) |
| ОР [95% ДИ] | 0.68 [0.51; 0.91] | |
| p-значение (логранговый критерий, стратифицированный*) | 0.0094 | |
| Общая выживаемость | ||
| Число (%) пациентов с событием | 46 (7.7%) | 35 (5.8%) |
| ОР [95% ДИ] | 0.75 [0.49; 1.17]^ | |
| p-значение (логранговый критерий. стратифицированный*) | 0.21^ | |
| Общая частота ответа** в конце индукционной терапии‡ (по оценке исследователя на основании данных КИ)# | ||
| Пациенты. ответившие на лечение (%) (ПО, ЧО) | 522 (86.9%) | 532 (88.5%) |
| Различие в частоте ответа (%) [95% ДИ] | 1.7% [-2.1%; 5.5%] | |
| p-значение (критерий Кохрана-Мантеля-Гензеля) | 0.33 | |
| Полный ответ (ПО) [95% ДИ Клоппера-Пирсона] | 143 (23.8%) [20.4%; 27.4%] | 117 (19.5%) [16.4%; 22.9%] |
| Частичный ответ (ЧО) [95% ДИ Клоппера-Пирсона] | 379 (63.1%) [59.1%; 66.9%] | 415 (69.1%) [65.2%; 72.7%] |
| Частота конверсии с конца индукционной терапии | ||
| Пациенты с ЧО в конце индукционной терапии | 222 | 271 |
| Конверсия ЧО в ПО | 97 (43.7%) | 134 (49.4%) |
| Различие в частоте ответа (%) [95% ДИ] | 5.7% [-3.1%; 14.6%] | |
| Общая частота ответа по завершении поддерживающей терапии | ||
| Оценка пациентов в конце поддерживающей терапии | 533 | 525 |
| Пациенты, ответившие на лечение (%) (ПО, ЧО) | 341 (64.0%) | 371 (70.7%) |
| Различие в частоте ответа (%) [95% ДИ] | 6.7% [1.0%, 12.4%] | |
| Значение p (критерий Кохрана-Мантеля-Хензеля) | 0.0197 | |
| Полный ответ (ПО) 95% ДИ Клоппера-Пирсона | 195 (36.6%) [32.5%, 40.8%] | 205 (39.0%) [34.9%, 43.4%] |
| Частичный ответ (ЧО) 95% ДИ Клоппера-Пирсона | 146 (27.4%) [23.7%, 31.4%] | 166 (31.6%) [27.7%, 35.8%] |
НЭК — Независимый экспертный комитет; ВБП — выживаемость без прогрессирования; ОР — отношение рисков; ДИ — доверительный интервал; Н/Д — не достигнуто.
* Факторами стратификации являлись схема химиотерапии, группа риска по классификации FLIPI для ФЛ, географический регион.
^Данные не готовы. На момент анализа медиана не была достигнута.
‡ Завершение индукционной терапии — конец периода индукционной терапии, не включает поддерживающую монотерапию.
** Оценено в соответствии с модифицированными критериями Cheson 2007.
§ Уровень значимости при промежуточном анализе эффективности: 0.012.
В конце индукционной терапии показатели ответа, оцениваемого по данным позитронно-эмиссионной томографии (ПЭТ), были зафиксированы у 297/601 пациентов в группе препарата Газива®+ химиотерапия, а также у 298/601 пациентов в группе ритуксимаб + химиотерапия. В конце индукционной терапии показатели полного ответа, оцениваемого по данным ПЭТ, были зафиксированы у 62.3% в группе препарата Газива® + химиотерапия и у 567% в группе ритуксимаб + химиотерапия. Показатели общего ответа были аналогичными в обеих группах лечения, с различием 4.3% в пользу группы препарата Газива® + химиотерапия (85.9% в группе Г-химио в сравнении с 81.5% в группе Р-химио).
Рисунок 4. Оценочные показатели выживаемости без прогрессирования у пациентов с ФЛ согласно оценке ИСС по кривой Каплана-Мейера
Результаты анализов в подгруппах
Результаты анализов в подгруппах в целом соответствовали результатам, полученным в популяции ФЛ, что является подтверждением устойчивости общего результата. Оцениваемые подгруппы включали IPI (International Prognostic Index, Международный прогностический индекс), FLIPI, схему химиотерапии, высокую опухолевую нагрузку, B-симптомы на исходном уровне, стадию по классификации Анн-Арбор и показатель ECOG на исходном уровне.
Рефрактерная/рецидивирующая ФЛ
В рамках открытого многоцентрового рандомизированного исследования III фазы (GAO4753g/GADOLIN) оценивались результаты лечения 396 пациентов с иНХЛ, которые не ответили на лечение или у которых наблюдалось прогрессирование на протяжении 6 месяцев после завершения лечения ритуксимабом или по схеме, включающей ритуксимаб. Пациентов рандомизировали в соотношении 1:1 либо в группу монотерапии бендамустином (Б) (n = 202), либо в группу терапии препаратом Газива® в комбинации с бендамустином (Г+Б) (n = 194) на протяжении 6 циклов, каждый из которых продолжался 28 дней. Пациенты в группе Г+Б, у которых не наблюдалось прогрессирования заболевания (т.е. пациенты с ПО, ЧО или стабильным заболеванием) в конце индукционной терапии, продолжали получать поддерживающую терапию препаратом Газива® до прогрессирования заболевания или в течение двух лет (в зависимости от того, какое событие наступало раньше).
Группы лечения были хорошо сбалансированы по демографическим данным и исходным характеристикам (медиана возраста составила 63 года, большинство пациентов были представителями европеоидной расы [88%] и мужского пола [58%]). Медиана времени с момента постановки первичного диагноза составила 3 года, а медиана количества предшествующих курсов терапии составила 2 (диапазон от 1 до 10); 44% пациентов получили 1 предшествующий курс терапии, а 34% пациентов получили 2 предшествующих курса терапии.
Препарат Газива® вводили в/в в первоначальной дозе 1000 мг в дни 1, 8 и 15 цикла 1, в день 1 циклов 2-6, а пациентам без прогрессирования заболевания — каждые 2 месяца в течение 2 лет или до прогрессирования заболевания. Бендамустин вводили в/в в дни 1 и 2 каждого цикла лечения (циклы 1-6) в дозе 90 мг/м2/сут в комбинации с препаратом Газива® либо в дозе 120 мг/м2/сут в качестве монотерапии.
Первичный анализ на основании оценки НЭК выявил статистически и клинически значимое (45%) снижение риска прогрессирования заболевания или смертельного исхода у пациентов с иНХЛ, получавших терапию по схеме Г+Б с последующей поддерживающей терапией препаратом Газива®, в сравнении с пациентами, получавшими монотерапию Б (стратифицированный логранговый критерий, значение р=0.0001). По оценке НЭК, частота достижения ответа в конце индукционной терапии и наилучший общий ответ за 12 месяцев с момента начала лечения были сходными в обеих группах лечения.
У большинства пациентов была диагностирована ФЛ (81.1%). Результаты первичного анализа эффективности в популяции ФЛ приведены в таблице 3, а также на рисунках 5 и 6. Среди пациентов с не-фолликулярной лимфомой у 11.6% была диагностирована лимфома маргинальной зоны (ЛМЗ), а у 7.1% - мелкоклеточная лимфоцитарная лимфома (МЛЛ).
Конкретных выводов в отношении эффективности в подгруппах ЛМЗ и МЛЛ сделать не удалось.
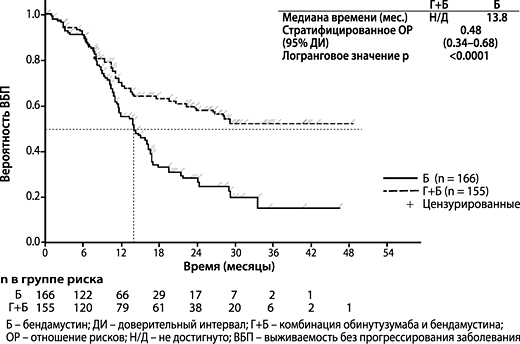
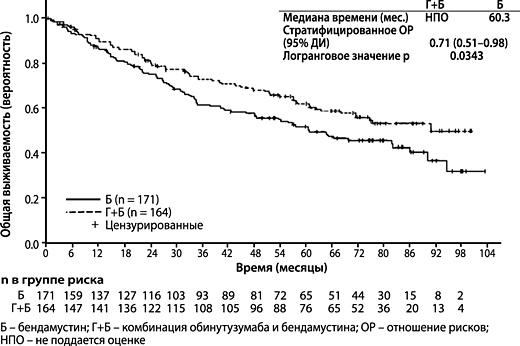
По данным финального анализа медиана времени наблюдения составила 45.9 месяца (диапазон: 0–100.9 месяца) для пациентов с ФЛ в группе Б и 57.3 месяца (диапазон: 0.4-97.6 месяца) для пациентов в группе Г+Б, что прибавило 25.6 месяца и 35.2 месяца к медиане продолжительности последующего наблюдения в группах Б и Г+Б соответственно с момента первичного анализа. При финальном анализе оценка конечных точек сообщалась только со стороны исследователя (ИСС), поскольку НЭК не проводил дальнейших оценок. В целом, полученные результаты оценки эффективности соответствовали результатам первичного анализа. Показатели ОВ у пациентов с ФЛ при увеличении продолжительности времени последующего наблюдения были стабильными (см. рисунок 7); ОР для риска летального исхода составило 0.71 (95% ДИ: 0.51, 0.98).
Таблица 3. Сводные результаты по данным первичного анализа эффективности в группе пациентов с ФЛ из исследования GAO4753g (GADOLIN)
| Бендамустин N = 166 | Г+Б, далее поддерживающая терапия препаратом Газива® N = 155 | |
| Медиана периода наблюдения 20 месяцев | Медиана периода наблюдения 22 месяца | |
| Первичная конечная точка в популяции ФЛ | ||
| ВБП по оценке НЭК (ВБП-НЭК) | ||
| Количество (%) пациентов с событием | 90 (54.2%) | 54 (34.8%) |
| Медиана длительности ВБП (месяцы) | 13.8 | Н/Д |
| ОР [95% ДИ] | 0.48 [0.34, 0.68] | |
| Значение p (логранговый критерий, стратифицированный*) | < 0.0001 | |
| Вторичные конечные точки | ||
| ВБП по оценке исследователя (ВБП-ИСС) | ||
| Количество (%) пациентов с событием | 102 (61.4%) | 62 (40.0%) |
| Медиана длительности ВБП (месяцы) | 13.7 | 29.2 |
| ОР [95% ДИ] | 0.48 [0.35, 0.67] | |
| Значение p (логранговый критерий, стратифицированный*) | < 0.0001 | |
| Наилучший общий ответ (НОО) (по оценке НЭК)§ | ||
| Количество пациентов, включенных в анализ | 161 | 153 |
| Пациенты, ответившие на лечение (%) (ПО, ЧО) | 124 (77.0%) | 122 (79.7%) |
| Различие в частоте ответа (%) [95% ДИ] | 2.72 [-6.74, 12.18] | |
| Значение p (критерий Кохрана-Мантеля-Хензеля) | 0.6142^ | |
| Длительность ответа (по оценке НЭК) | ||
| Количество пациентов, включенных в анализ | 127 | 122 |
| Число (%) пациентов с событием | 74 (58.3%) | 36 (29.5%) |
| Медиана длительности ответа (месяцы) | 11.9 | Н/Д |
| ОР [95% ДИ] | 0.36 [0.24, 0.54] | |
| Общая выживаемость | ||
| Число (%) пациентов с событием | 36 (21.7%) | 25 (16.1%) |
| Медиана времени до наступления события (месяцы) | Н/Д^ | Н/Д^ |
| ОР [95% ДИ] | 0.71 [0.43, 1.19]^ | |
| Значение p (логранговый критерий, стратифицированный*) | 0.1976^† | |
| Общая частота ответа в конце индукционной терапии‡ (по оценке НЭК) | ||
| Оценка пациентов в конце лечения | 155 | 149 |
| Пациенты, ответившие на лечение (%) (ПО, ЧО) | 97 (62.6%) | 105 (70.5%) |
| Различие в частоте ответа (%) [95% ДИ] | 7.89 [-3.05, 18.83] | |
| Значение p (критерий Кохрана-Мантеля-Хензеля) | 0.1713 | |
| Полный ответ (ПО) | 21 (13.5%) | 14 (9.4%) |
| Частичный ответ (ЧО) | 76 (49.0%) | 91 (61.1%) |
| Стабильное заболевание (СЗ) | 15 (9.7%) | 12 (8.1%) |
| Прогрессирование заболевания (ПЗ) | 15 (9.7%) | 15 (10.1%) |
| Невозможно оценить (НО) | 4 (2.6%) | 3 (2.0%) |
| Отсутствует (Н/П) | 24 (15.5%) | 14 (9.4%) |
НЭК - Независимый экспертный комитет; ВБП - выживаемость без прогрессирования; ОР - отношение рисков; ДИ - доверительный интервал; Н/Д - не достигнуто.
* Факторами стратификации являлись подтипы иНХЛ (фолликулярная в сравнении с не-фолликулярной: не применяли при анализе пациентов с ФЛ), тип рефрактерности (монотерапия ритуксимабом в сравнении с комбинацией ритуксимаба и химиотерапии), а также количество предшествующих курсов терапии (≤ 2 в сравнении с > 2).
§ Наилучший ответ за 12 месяцев с момента начала лечения.
^ Данные не готовы.
‡ Завершение индукционной терапии - конец периода индукционной терапии, не включает поддерживающую монотерапию.
Рисунок 5. График Каплана-Мейера, на котором представлены данные, касающиеся ВБП у пациентов с ФЛ, по оценке НЭК
Результаты анализов в подгруппах
Результаты анализов в подгруппах в целом соответствовали результатам, полученным в популяции ФЛ, что является подтверждением надежности общего результата.
Рисунок 6. Форест-диаграмма анализов в подгруппах пациентов с ФЛ
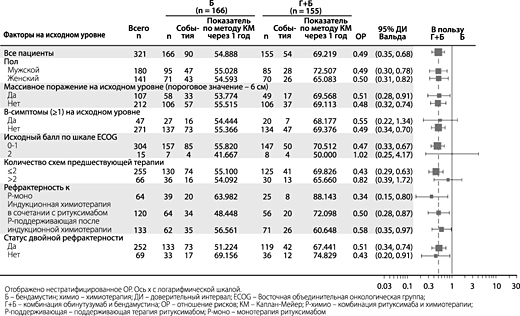
Рисунок 7. Кривая Каплана-Мейера, отображающая ОВ у пациентов с ФЛ на момент итогового анализа
Исследование коротких инфузий (MO40597/GAZELLE)
В рамках открытого многоцентрового одногруппового исследования с участием 113 пациентов с ранее нелеченной распространенной ФЛ (исследование MO40597/GAZELLE) оценивали безопасность короткой (приблизительно 90 мин) инфузии обинутузумаба, вводимого в комбинации с химиотерапией по схеме СНОР, CVP или бендамустином.
В дни 1, 8 и 15 цикла 1 пациенты получали обинутузумаб со стандартной скоростью инфузии. Пациенты, у которых не было зарегистрировано развития ИР ≥ 3 степени тяжести во время первого цикла лечения, получали препарат Газива® путем коротких инфузий, начиная с цикла 2.
Первичной конечной точкой исследования была доля пациентов, у которых наблюдалось развитие ИР ≥ 3 степени, связанных с короткими инфузиями в цикле 2, среди тех, кто ранее получил 3 инфузии обинутузумаба при стандартной скорости введения во время цикла 1 без развития ИР ≥ 3 степени.
У пациентов, получавших короткие инфузии в цикле 2, не было зарегистрировано развития ИР ≥ 3 степени. После завершения цикла 2 только у одного пациента было зарегистрировано развитие ИР 3 степени (артериальная гипертензия во время цикла 5).
После коротких инфузий жизнеугрожающие ИР, ИР с летальным исходом и серьезные ИР не наблюдались.
Исходы, сообщаемые пациентами
Ранее нелеченная фолликулярная лимфома
Как показывают данные, собиравшиеся для опросника FACT-Lym ("Функциональная оценка терапии рака - лимфома") на протяжении лечения и последующего наблюдения, у пациентов обеих групп лечения было отмечено клинически значимое улучшение со стороны симптомов лимфомы в виде увеличения на ≥ 3 балла в сравнении с исходным уровнем по подшкале оценки лимфомы, на ≥ 6 баллов в сравнении с исходным уровнем согласно показателю по шкале FACT Lym TOI (Trial Outcome Index, показатель результата исследования) и на ≥ 7 баллов в сравнении с исходным уровнем по шкале FACT Lym Total score (общий показатель). Значения общего индекса полезности по опроснику EQ-5D (European Quality of Life 5 Dimensions Questionnaire, Европейский опросник для оценки качества жизни) были аналогичными на исходном уровне, во время лечения и в период последующего наблюдения. Значимых различий между группами по показателям HRQOL (health-related quality of life, качество жизни, связанное со здоровьем) или общего состояния здоровья не наблюдалось.
Рефрактерная/рецидивирующая фолликулярная лимфома
Как показывают данные, собиравшиеся для опросника FACT-Lym на протяжении лечения и этапов последующего наблюдения, а также индексы по шкалам опросника EQ-5D, качество жизни, связанное со здоровьем, в целом сохранялось на протяжении опорного исследования при отсутствии значимых различий между группами лечения. Тем не менее добавление препарата Газива® к бендамустину увеличило время до ухудшения качества жизни в соответствии с показателем TOI по шкале FACT Lym (ОР=0.83; 95% ДИ: 0.60, 1.13).
Волчаночный нефрит
Было проведено многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы в параллельных группах (CA41705/REGENCY), направленное на сравнение эффективности и безопасности препарата Газива® по отношению к плацебо у пациентов с ВН класса III или IV с сопутствующим ВН класса V или без него согласно классификации ISN/RPS 2003 г., которые получали стандартную терапию, включающую в себя ММФ и кортикостероиды.
У пациентов был активный или активный/хронический ВН согласно классификации ISN/RPS 2003 г. класса III или IV с сопутствующим пролиферативным ВН класса V или без него по результатам биопсии почек, положительный анализ на антинуклеарные антитела (АНА) на момент оценки или в прошлом, соотношение белок-креатинин в моче (СБКМ) ≥ 1 г/г, пациенты также получили как минимум одну дозу пульс-терапии метилпреднизолоном в/в (≥ 250 мг) или эквивалентную терапию по поводу ВН в течение 6 месяцев, предшествующих скринингу, или в период скрининга.
Из исследования исключались пациенты с расчетной скоростью клубочковой фильтрации (рСКФ) < 30 мл/мин/1.73 м2 или имеющие показания к гемодиализу или трансплантации почек, с наличием склерозирования в >50% гломерул по результатам биопсии почек, с быстро прогрессирующим гломерулонефритом, признаками активной инфекции, получавшие
терапию антителами к CD20 в течение < 9 месяцев до или во время скрининга, или получавшие циклофосфамид, такролимус, циклоспорин или воклоспорин в течение 2 месяцев до или во время скрининга.
В общей сложности 271 пациент был рандомизирован в соотношении 1:1 в группы в/в введения препарата Газива® в дозе 1000 мг или плацебо в комбинации с ММФ в дозе 2-2.5 г/сут и курсом ГКС со снижением дозы. Состояние данных пациентов оценивали в течение 76 недель. Пациенты, рандомизированные в группу препарата Газива®, были дополнительно рандомизированы в соотношении 1:1 в группы, получавшие препарат Газива® в дозе 1000 мг в/в в день 1, на неделях 2, 24, 26, 50 и 52 (группа 1) или препарат Газива® в дозе 1000 мг в/в в день 1 на неделях 2, 24, 26 и 52 (группа 2). Совокупность данных по эффективности препарата Газива®, полученных в обеих группах лечения, представлена в таблице 4.
Все пациенты получали преднизон перорально в дозе 0.5 мг/кг/сут (максимум 60 мг/сут) и продолжали получать эту дозу до недели 2. Начиная с дня 15, дозу преднизона постепенно снижали до целевого уровня 5 мг/сут к неделе 24. Применение преднизона в низкой дозе (5 мг/сут) продолжалось с недели 24 до недели 80.
Медиана возраста пациентов составляла 31 год, 84.5% пациентов были женского пола, 57.6% были латиноамериканского происхождения, 47.6% относились к европеоидной расе и 14.8% - к негроидной расе или были афроамериканцами. Распределение по классам в соответствии с результатами биопсии почек было следующим: 39.5% класс III, 60.5% класс IV и 31.4% имели сопутствующее поражение класса V. Среднее значение (СО) рСКФ на исходном уровне составляло 102.3 (±30.8) мл/мин/1.73 м2. Среднее значение (СО) СБКМ на исходном уровне составляло 3.34 (±2.87) мг/мг, причем у 42.2% пациентов исходное значение СБКМ составляло ≥3 мг/мг.
Первичным показателем эффективности была доля пациентов, достигших полного ответа на лечение со стороны почек (ППО) на неделе 76, который определялся как соответствие всем перечисленным ниже критериям: СБКМ < 0.5 г/г; рСКФ ≥ 85% относительно исходного уровня, рассчитанная по формуле Рабочей группы по эпидемиологии хронической болезни
почек (CKD-EPI) 2009 г.; отсутствие следующих интеркуррентных событий: применение резервной терапии, неэффективность лечения, смерть или досрочное выбывание из исследования.
Основные вторичные показатели эффективности включали: долю пациентов, достигших ППО на фоне успешного снижения дозы преднизона на неделе 76 (определяется как достижение ППО на неделе 76 без применения преднизона в дозе >7.5 мг/сут или эквивалентной терапии с недели 64 до недели 76), долю пациентов, у которых достигнут ответ по показателю
протеинурии на неделе 76 (определяется как достижение уровня СБКМ < 0.8 г/г и отсутствие следующих интеркуррентных событий: применение резервной терапии, неэффективность лечения, смерть или досрочное выбывание из исследования), а также долю пациентов, у которых наступила смерть или развились явления, связанные с почками, до недели 76 (определяется как наступление смерти, неэффективность лечения, повышение СБКМ на ≥ 50% до значения ≥ 3 и/или снижение рСКФ на ≥ 30% до значения < 60).
Доля пациентов, достигших ППО на неделе 76, в группе препарата Газива® в комбинации со стандартной терапией, была значительно выше (46.4%), чем в группе плацебо в комбинации со стандартной терапией (33.1%) (см. таблицу 4). ППО на неделе 76 был достигнут у 42.7% пациентов, получавших препарат Газива® в комбинации со стандартной терапией, на фоне снижения дозы преднизона до ≤ 7.5 мг/сут или эквивалентной терапии с недели 64 до недели 76, тогда как в группе плацебо этот показатель составлял 30.9% (см. таблицу 4).
Таблица 4. Краткий обзор показателей эффективности у взрослых пациентов с ВН в исследовании REGENCY
| Плацебо + стандартная терапия (N=136) | Препарат Газива® + стандартная терапия (N=135) | |
| Первичная конечная точка | ||
| ППО на неделе 76 (%) Различие в лечении (95% ДИ) p-значение | 33.1 (25.18, 41.00) 46.4 (37.95, 54.86) 13.40 (1.95, 24.84) 0.0232 | |
| Компоненты ППО: СБКМ < 0.5 г/г рСКФ ≥ 85% на исходном уровне Отсутствие интеркуррентных событий | 49 (36.0%) 103 (75.7%) 102 (75.0%) | 64 (47.4%) 113 (83.7%) 120 (88.9%) |
| Основные вторичные конечные точки | ||
| ППО на фоне успешного снижения дозы преднизона на неделе 76 (%) Различие в лечении (95% ДИ) p-значение | 30.9 (23.12, 38.65) | 42.7 (34.32, 51.09) |
| 11.88 (0.57, 23.18) | ||
| 0.0421 | ||
| Ответ на лечение по показателю протеинурии на неделе 76 (%) Различие в лечении (95% ДИ) p-значение | 41.9 (33.62, 50.20) | 55.5 (47.09, 63.95) |
| 13.68 (2.01, 25.36) | ||
| 0.0227 | ||
У пациентов, получавших препарат Газива® в комбинации со стандартной терапией, было отмечено клинически, но не статистически значимое снижение (18.9%) частоты летальных исходов или явлений, связанных с почками, по сравнению с пациентами, получавшими плацебо в комбинации со стандартной терапией (35.6%) (различие -16.83% [95% ДИ от -27.42 до -6.23]).
Результаты анализов в подгруппах
Предварительно определенные анализы основной конечной точки показали стабильный терапевтический эффект от лечения препаратом Газива® во всех подгруппах с разной активностью заболевания. Исследование REGENCY не обладало статистической мощностью для оценки эффективности в отдельных подгруппах.
Среди пациентов с исходным значением СБКМ ≥ 3 г/г (n=114), ППО был достигнут у 36.5% в группе препарата Газива®, по сравнению с 17.7% в группе плацебо (различие 17.78% [95% ДИ от 1.63% до 33.93%]), тогда как у пациентов со значением СБКМ < 3 г/г (n=156), ППО был достигнут у 52.0% в группе препарата Газива, по сравнению с 45.9% в группе плацебо (различие 7.77% [95% ДИ от -7.71% до 23.25%]).
Среди пациентов с ВН класса IV по результатам исходной биопсии (n=164), ППО был достигнут у 44.2% в группе препарата Газива, по сравнению с 28.2% в группе плацебо (различие 15.17% [95% ДИ от 0.80% до 29.54%]), тогда как среди пациентов с ВН класса III по результатам биопсии (n=107), ППО был достигнут у 49.5% в группе препарата Газива®, по сравнению с 41.2% в группе плацебо (различие 7.05% [95% ДИ от -11.52% до 25.63%]).
Среди пациентов с сопутствующим ВН класса V (n=85), ППО был достигнут у 49.1% в группе препарата Газива®, по сравнению с 23.7% в группе плацебо (различие 25.53% [95% ДИ от 6.33% до 44.73%]), тогда как среди пациентов без ВН класса V (n=186), ППО был достигнут у 45.0% в группе препарата Газива®, по сравнению с 36.7% в группе плацебо (различие 8.82% [95% ДИ от -5.16% до 22.80%]).
Иммуногенность
Результаты анализа иммуногенности в значительной степени зависят от различных факторов, таких как чувствительность и специфичность анализа, методология проведения анализа, чувствительность анализа к концентрации препарата Газива®/антител в сыворотке крови, манипуляции с забранными образцами, время забора образцов, сопутствующие препараты и характер основного заболевания. Таким образом, сравнение частоты обнаружения антител к препарату Газива® и частоты обнаружения антител к другим биологическим препаратам может оказаться неинформативным.
В опорном клиническом исследовании BO21004/CLL11 тестирование на наличие антитерапевтических антител (AТA) проводилось в различных временных точках у пациентов с ХЛЛ. Среди пациентов, получавших препарат Газива®, у 8 из 140 на этапе рандомизации и у 2 из 6 в течение вводной фазы были обнаружены АТА через 12 месяцев после завершения последнего цикла терапии. У пациентов не выявлено случаев анафилаксии или реакций гиперчувствительности, связанных с AТA, или негативного влияния на клинический ответ.
У пациентов с иНХЛ в исследовании GAO4753g/GADOLIN не отмечалось образования антител человека к антителам человеческого происхождения (HAHA – Human Anti-Human Antibody) по сравнению с исходным уровнем. В исследовании ВО21223/GALLIUM у 1 пациента из 565 (0.2%) с ранее нелеченной ФЛ развивались HAHA на момент завершения индукции. Несмотря на то, что клиническая значимость HAHA неизвестна, потенциальная взаимосвязь между развитием HAHA и клиническим течением заболевания не может быть исключена.
Среди пациентов, получавших лечение препаратом Газива® в исследованиях ВН, в общей сложности у 12 из 200 (6%) был получен как минимум один положительный результат анализа на антитела к лекарственному препарату (АЛП) в тот или иной момент времени. У шести (3%) пациентов положительный результат анализа на АЛП был получен на исходном уровне. У двух из 6 пациентов с исходно положительным результатом анализа на АЛП этот показатель оставался положительным на протяжении всех исследований, у 1 пациента был получен только один положительный результат после исходного уровня, у оставшихся 3 пациентов результаты анализов на АЛП после исходного уровня были отрицательными. У шести (3%)пациентов с исходно отрицательными результатами анализа на АЛП после исходного уровня был получен положительный титр АЛП (индуцированные терапией АЛП).
Ни у кого из 12 пациентов с положительными титрами АЛП ни в один из моментов времени в период лечения не возникало ИР или анафилактических реакций/реакций гиперчувствительности во время исследования.
Данные доклинической безопасности
Канцерогенность
Исследования канцерогенности для установления канцерогенного потенциала препарата Газива® не проводились.
Генотоксичность
Исследования для установления генотоксического потенциала препарата Газива® не проводились.
Нарушения фертильности
Специальные исследования у животных для оценки влияния препарата Газива® на фертильность не проводились. Нежелательные явления со стороны репродуктивных органов самцов и самок яванских макак в ходе исследований токсичности при многократном введении препарата не наблюдались.
Репродуктивная токсичность
Было проведено углубленное исследование токсичности препарата в пре- и постнатальном периоде у беременных яванских макак. Беременным животным еженедельно в/в вводили препарат Газива® (медиана AUC0-168 ч в равновесном состоянии (в день 139 после зачатия) составляла 125000 и 250000 (мкг×час)/мл при дозах 25 и 50 мг/кг соответственно. Медиана Cmax составляла 1220 и 2470 мкг/мл при дозах 25 и 50 мг/кг, соответственно) на протяжении периода гестации (период органогенеза, со дня 20 после зачатия до родов).
У подверженного воздействию потомства не наблюдалось каких-либо тератогенных эффектов, однако B-клетки были полностью истощены на 28 день после рождения. Уровень экспозиции у потомства на 28-й день после родов позволяет предположить, что препарат Газива® может проникать через гематоплацентарный барьер. Концентрации препарата в сыворотке крови потомства на 28-й день после рождения находились в пределах соответствующих концентраций в материнской сыворотке крови, в то время как концентрации препарата в молоке в тот же день были очень низкими (менее 0.5% от соответствующего уровня в материнской сыворотке крови), что позволяет предположить, что экспозиция у потомства была достигнута внутриутробно. Число B-клеток вернулось к нормальным уровням, а иммунологическая функция восстановилась в течение 6 месяцев после родов.
Прочее
В ходе 26-недельного исследования у яванских макак были зафиксированы реакции гиперчувствительности, возникшие в результате распознавания гуманизированного антитела у яванских макак как чужеродного (Cmax и AUC0-168 ч в равновесном состоянии (день 176) после еженедельного введения 5, 25 и 50 мг/кг составляли 377, 1530 и 2920 мкг/мл и 39800, 183000 и 344000 (мкг×час)/мл соответственно).
Зафиксированные результаты включали острые анафилактические или анафилактоидные реакции и повышенную распространенность системного воспаления и инфильтраций, что соответствует иммуноопосредованным реакциям гиперчувствительности, таких как артериит/периартериит, гломерулонефрит и серозное/адвентициальное воспаление.
Возникновение этих реакций привело к преждевременному прекращению лечения у 6/36 особей, получавших обинутузумаб, на стадиях лечения и восстановления; эти изменения были частично обратимыми. Причинно-следственной связи между развитием нефротоксичности и применением обинутузумаба у человека не наблюдалось.
Фармакокинетика
Была разработана популяционная фармакокинетическая модель для анализа фармакокинетических данных у 469 пациентов с иНХЛ (преимущественно ФЛ), 342 пациентов с ХЛЛ и 130 пациентов с диффузной В-крупноклеточной лимфомой (ДБККЛ), которые получали препарат Газива® в исследованиях I, II и III фазы.
Была разработана популяционная фармакокинетическая модель для анализа фармакокинетических данных 196 пациентов с ВН, которые получали препарат Газива® в исследованиях II и III фазы.
Всасывание
Хронический лимфолейкоз и фолликулярная лимфома
Препарат Газива® вводится в/в. Другие пути введения препарата не изучались.
Рассчитанное значение медианы Cmax после инфузии в цикле 6, день 1 у пациентов с ХЛЛ составило 465.7 мкг/мл, а значение AUC за период дозирования (AUCτ) составило 8961 мкг×д/мл и у пациентов с иНХЛ – 539.3 мкг/мл и 10956 мкг×д/мл, соответственно.
Волчаночный нефрит
На основании популяционной фармакокинетической модели у пациентов с ВН расчетное значение медианы Cmax в равновесном состоянии составило 468 мкг/мл, а AUC в равновесном состоянии составила 8740 мкг×д/мл.
Распределение
Хронический лимфолейкоз и фолликулярная лимфома
После в/в введения объем распределения в центральной камере (Vc) составляет 2.72 л и приблизительно равен объему сыворотки крови, что свидетельствует тому, что распределение в значительной степени происходит в плазме крови и внеклеточной жидкости.
Волчаночный нефрит
После в/в введения Vc составляет 2.22 л и приблизительно равен объему сыворотки крови, что свидетельствует тому, что распределение в значительной степени происходит в плазме крови и внеклеточной жидкости.
Метаболизм
Отдельных исследований метаболизма препарата Газива® не проводилось. Как и другие антитела, обинутузумаб преимущественно подвергается катаболизму.
Выведение
Хронический лимфолейкоз и фолликулярная лимфома
Клиренс обинутузумаба у пациентов с ХЛЛ составлял примерно 0.11 л/сут и у пациентов с иНХЛ примерно 0.08 л/сут с медианой T1/2 26.4 сут при ХЛЛ и 36.8 сут для иНХЛ.
Выведение обинутузумаба характеризуется как линейным клиренсом, так и нелинейным клиренсом. В начальном периоде лечения зависящий от времени нелинейный клиренс является основным, но с продолжением терапии его вклад постепенно уменьшается, и доминирующим становится линейный путь. Это указывает на опосредованное мишенью распределение препарата (ОМРП), при котором избыток CD20+ B-клеток определяет резкое снижение концентрации обинутузумаба в сыворотке крови. Когда большинство CD20+ В-клеток связано с обинутузумабом, ОМРП оказывает минимальное влияние на фармакокинетику препарата.
Волчаночный нефрит
Клиренс препарата Газива® в равновесном состоянии составлял приблизительно 0.13 л/сут с медианой T1/2, составляющей 22.4 сут.
Выведение препарата Газива® характеризуется двумя параллельными путями клиренса: линейным клиренсом и нелинейным клиренсом, который изменяется в зависимости от времени. Зависящий от времени клиренс снижается со временем с коэффициентом экспоненциального сглаживания, что, вероятно, связано со снижением целевого уровня CD20 и улучшением показателя протеинурии с течением времени, а независимый от времени клиренс связан с эндогенными катаболическими процессами IgG.
Особые группы пациентов
Пациенты пожилого возраста
Хронический лимфолейкоз и фолликулярная лимфома.Анализ популяционной фармакокинетики обинутузумаба показал, что возраст не оказывает влияния на фармакокинетические свойства обинутузумаба. Не отмечено значительных различий в фармакокинетике обинутузумаба у пациентов в возрасте < 65 лет (n=454), от 65 до 75 лет (n=317) и у пациентов в возрасте > 75 лет (n=190).
Волчаночный нефрит.Исследований фармакокинетики препарата Газива® у пациентов в возрасте 65 лет и старше не
проводилось.
Нарушение функции почек
Хронический лимфолейкоз и фолликулярная лимфома.Анализ популяционной фармакокинетики обинутузумаба показал, что КК не оказывает влияния на фармакокинетические свойства обинутузумаба. Значения фармакокинетических параметров обинутузумаба у пациентов с нарушением функции почек легкой (КК 50-89 мл/мин, n=464) и средней (КК 30-49 мл/мин, n=106) степени тяжести схожи с таковыми у пациентов с нормальной функцией почек (КК ≥ 90 мл/мин, n=383). Данные по фармакокинетике у пациентов с нарушением функции почек тяжелой степени (КК 15-29 мл/мин) ограничены (n=8), поэтому дать специальные указания по дозированию не представляется возможным.
Волчаночный нефрит.Анализ популяционной фармакокинетики препарата Газива® показал, что КК не оказывает
влияния на фармакокинетику обинутузумаба у пациентов с ВН. Показатели фармакокинетики обинутузумаба у пациентов с нарушением функции почек легкой или средней степени тяжести были сходны с таковыми у пациентов с нормальной функцией почек. Безопасность и эффективность препарата Газива® у пациентов с нарушением функции почек тяжелой степени формально не изучались.
Нарушение функции печени
Хронический лимфолейкоз и фолликулярная лимфома.Специальных исследований фармакокинетики у пациентов с нарушениями функции печени не проводилось.
Волчаночный нефрит.Формального фармакокинетического исследования и сбора популяционных фармакокинетических данных у пациентов с нарушением функции печени не проводилось. Молекулы IgG1, такие как обинутузумаб, подвергаются катаболизму под действием широко распространенных протеолитических ферментов, которые не ограничены только тканью печени, поэтому маловероятно, что изменения функции печени оказывают какое-либо влияние на элиминацию обинутузумаба.
Раса и пол
По данным популяционного анализа, клиренс в равновесном состоянии Vd у мужчин выше на 18% и 19%, соответственно. Тем не менее, отличия в экспозиции обинутузумаба у мужчин и у женщин незначительны (при ХЛЛ установленные медианы AUC и Cmax в 6 цикле составили 11282 мкг×д/мл и 578.9 мкг/мл у женщин и 8451 мкг×д/мл и 432.5 мкг/мл у мужчин соответственно; при иНХЛ медианы AUC и Cmax составили 13172 мкг×д/мл и 635.7 мкг/мл у женщин и 9769 мкг×д/мл и 481.3 мкг/мл у мужчин соответственно), коррекции дозы в зависимости от пола не требуется.
Дети
Исследований по фармакокинетике препарата Газива® у пациентов детского возраста не проводилось.
Показания препарата Газива®
Хронический лимфолейкоз
- в комбинации с хлорамбуцилом у взрослых старше 18 лет с ранее нелеченным хроническим лимфолейкозом (ХЛЛ) и с сопутствующими заболеваниями, при которых невозможно проведение терапии на основе флударабина в полной дозе.
Фолликулярная лимфома
- в комбинации с химиотерапией с последующей поддерживающей монотерапией препаратом Газива® (при достижении как минимум частичной ремиссии) у взрослых в возрасте старше 18 лет с ранее нелеченной распространенной фолликулярной лимфомой (ФЛ) (стадия II с любыми нодальными и экстранодальными вовлечениями ≥7 см в диаметре, стадия III или IV);
- в комбинации с бендамустином и последующей поддерживающей монотерапией препаратом Газива® у взрослых в возрасте старше 18 лет с ФЛ, не ответивших на лечение ритуксимабом или на лечение по содержащей ритуксимаб схеме, или у которых развилось прогрессирование заболевания во время или в течение 6 месяцев после такого лечения.
Волчаночный нефрит
- в комбинации с иммуносупрессивной терапией - у взрослых для лечения активного волчаночного нефрита (ВН) III или IV (в сочетании или без V) морфологических классов.
| Код МКБ-10 | Показание |
| C82 | Фолликулярная [нодулярная] неходжкинская лимфома |
| C91.1 | Хронический лимфоцитарный В-клеточный лейкоз |
Режим дозирования
Терапия препаратом Газива® назначается онкологом, гематологом, ревматологом или нефрологом. Введение препарата проводится при наличии доступа к набору для оказания экстренной помощи.
Врач, имеющий опыт применения химиотерапевтических препаратов, должен быть доступен в процессе проводимой терапии.
Препарат Газива® вводят в/в капельно, через отдельный катетер.
Нельзя вводить препарат в/в струйно или болюсно.
Препарат Газива® должен вводиться квалифицированным медицинским персоналом. Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Премедикация и профилактика синдрома лизиса опухоли (СЛО)
Пациентам с высокой опухолевой нагрузкой и/или с высоким содержанием лимфоцитов (>25×109/л) и/или нарушением функции почек (КК <70 мл/мин) требуется профилактика СЛО, поскольку они находятся в группе риска развития СЛО. Профилактика включает адекватную гидратацию и назначение гипоурикемических препаратов (например, аллопуринола или других альтернативных препаратов, таких как препараты урат-оксидазного фермента, например, расбуриказа) перед инфузией препарата Газива® в соответствии со стандартной практикой (см. раздел "Особые указания"). В случае если состояние пациента по-прежнему соответствует критериям СЛО, перед каждой последующей инфузией также необходимо проводить профилактику СЛО.
Премедикация и профилактика инфузионных реакций (ИР)
Информация о проведении премедикации для снижения риска развития инфузионных реакций (см. раздел "Особые указания") приведена в таблице 5. Премедикация ГКС рекомендована для пациентов с фолликулярной лимфомой (ФЛ) и обязательна для пациентов с хроническим лимфолейкозом (ХЛЛ) при первой инфузии и для пациентов с ВН (см. таблицу 5). Премедикацию при последующих инфузиях и другие виды премедикации следует проводить как описано ниже.
Учитывая то, что одним из проявлений инфузионных реакций может быть артериальная гипотензия, следует рассмотреть возможность приостановки лечения антигипертензивными средствами в течение 12 ч перед каждой инфузией на протяжении инфузии и в течение 1 ч после ее окончания.
Таблица 5. Премедикация перед введением препарата Газива®, необходимая для снижения риска развития инфузионных реакций (ИР)
| День цикла приема препарата | Пациенты, требующие премедикации | Лекарственное средство | Применение |
| Цикл 1 ХЛЛ День 1, 2 ФЛ День 1 | Все пациенты | ГКС, в/в1,2 | Введение необходимо завершить не менее чем за 1 ч до начала инфузии препарата Газива® |
| Анальгетик/антипиретик для приема внутрь3 | Не менее чем за 30 мин до начала инфузии препарата Газива® | ||
| Антигистаминный препарат4 | |||
| Все последующие инфузии ХЛЛ и ФЛ | Пациенты без ИР при предшествующей инфузии | Анальгетик/антипиретик для приема внутрь3 | Не менее чем за 30 мин до начала инфузии препарата Газива® |
| Пациенты с ИР (1 или 2 степени) при предшествующей инфузии | Анальгетик/антипиретик для приема внутрь3 | Не менее чем за 30 мин до начала инфузии препарата Газива® | |
| Антигистаминный препарат4 | |||
| Пациенты с ИР 3 степени при предшествующей инфузии ИЛИ пациенты с числом лимфоцитов >25×109/л перед проведением инфузии | ГКС, в/в1 | Введение необходимо завершить не менее чем за 1 ч до начала инфузии препарата Газива® | |
| Анальгетик/антипиретик для приема внутрь3 | Не менее чем за 30 мин до начала инфузии препарата Газива® | ||
| Антигистаминный препарат4 | |||
| ВН | Все пациенты | ГКС, в/в5 | Введение необходимо завершить за 30–60 минут до начала инфузии препарата Газива® |
| Анальгетик/антипиретик для приема внутрь6 | Начиная с дозы 6, в/в введение ГКС следует проводить только пациентам, у которых развивалась ИР во время предшествующей инфузии | ||
| Антигистаминный препарат4 |
1100 мг преднизона/преднизолона или 20 мг дексаметазона или 80 мг метилпреднизолона. Не следует применять гидрокортизон, т.к. он не является эффективным для предотвращения ИР.
2 Профилактическое в/в введение ГКС не требуется в том случае, если препарат Газива® вводится в один день с комплексной химиотерапией, уже содержащей ГКС. В таком случае необходимо принять ГКС перорально как минимум за 60 мин до введения препарата Газива®.
3например, 1000 мг ацетаминофена/парацетамола.
4например, 50 мг дифенгидрамина.
580 мг метилпреднизолона в/в.
6650–1000 мг ацетаминофена/парацетамола.
Хронический лимфолейкоз (в комбинации с хлорамбуцилом (см. раздел "Фармакологическое действие"))
Цикл 1
Рекомендуемая доза препарата Газива® составляет 1000 мг в/в в течение дня 1 и 2, далее в день 8 и день 15 1-го 28-дневного цикла, как указано в таблице 6.
Для введения первой дозы препарата Газива® необходимо подготовить два инфузионных пакета, содержащих 100 мг препарата для первой инфузии и 900 мг для второй инфузии.
В том случае, если при введении 100 мг препарата Газива® не потребуется снизить скорость или прервать введение препарата, то 900 мг препарата Газива® можно вводить в тот же день (без приостановки лечения) при условии, что в течение всей инфузии имеются соответствующие условия, необходимое время для проведения инфузии и медицинское наблюдение. Если введение 100 мг препарата пришлось прервать или изменить скорость, вводить 900 мг в тот же день нельзя (см. таблицу 6).
Циклы 2-6
Рекомендуемая доза препарата Газива® составляет 1000 мг с введением в день 1 каждого 28-дневного цикла лечения, как указано в таблице 6.
Таблица 6. Введение препарата Газива® при ХЛЛ
| День цикла терапии | Доза препарата Газива® | Скорость инфузии (рекомендации по купированию ИР, возникающих во время введения, указаны в таблице 11) | |
| Цикл 1 | День 1 | 100 мг | 25 мг/ч в течение 4 ч. Не увеличивать скорость инфузии. |
| День 2 или День 1 (продолжение) | 900 мг | Если во время предыдущей инфузии не возникло инфузионных реакций, скорость инфузии составляет 50 мг/ч. Скорость инфузии можно постепенно увеличивать с шагом 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. Если во время предыдущей инфузии развилась ИР, начальная скорость инфузии должна составлять 25 мг/ч. Скорость инфузии можно постепенно увеличивать с шагом не более 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. | |
| День 8 | 1000 мг | Если во время предыдущей инфузии (конечная скорость инфузии ≥100 мг/ч) не возникло инфузионных реакций, начальная скорость инфузии может быть 100 мг/ч и затем постепенно увеличиваться с шагом 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. Если во время предыдущей инфузии развилась ИР, начальная скорость инфузии должна составлять 50 мг/ч. Скорость инфузии можно постепенно увеличивать с шагом 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. | |
| День 15 | 1000 мг | ||
| Циклы 2-6 | День 1 | 1000 мг | |
Пропуск дозы (ХЛЛ)
При пропуске запланированной дозы препарата Газива® необходимо ввести препарат как можно раньше; не следует ждать следующего запланированного введения. Между введениями следует выдерживать рекомендуемый интервал.
Фолликулярная лимфома
Рекомендуемая доза препарата Газива® составляет 1000 мг в/в как указано в таблице 7.
Ранее нелеченная фолликулярная лимфома
- 6 28-дневных циклов в комбинации с бендамустином
или
- 6 21-дневных циклов в комбинации с CHOP (циклофосфамид, доксорубицин, винкристин и преднизолон), затем 2 дополнительных цикла препарата Газива® в монотерапии
или
- 8 21-дневных циклов в комбинации с CVP (циклофосфамид, винкристин, преднизолон).
Пациенты с ранее нелеченной ФЛ, ответившие на терапию препаратом Газива® в комбинации с химиотерапией с достижением полного или частичного ответа, должны продолжать поддерживающую терапию препаратом Газива® в виде монотерапии в дозе 1000 мг 1 раз в 2 месяца не более 2 лет. При прогрессировании заболевания терапию препаратом Газива® следует прекратить.
Рефрактерная/рецидивирующая фолликулярная лимфома
Пациентам с ФЛ, не ответившим на ритуксимаб-содержащую терапию или имевшим прогрессирование заболевания во время/после такой терапии, следует вводить препарат Газива® в комбинации с бендамустином в течение 6 28-дневных циклов.
Пациенты с рефрактерной/рецидивирующей ФЛ, которые достигли полного или частичного ответа, или пациенты со стабильным заболеванием должны продолжать поддерживающую терапию препаратом Газива® в виде монотерапии в дозе 1000 мг один раз в 2 месяца не более 2 лет. При прогрессировании заболевания терапию препаратом Газива® следует прекратить.
Препарат Газива® следует вводить со стандартной скоростью инфузии в цикле 1 (см. таблицу 7). Пациентам, у которых не возникает инфузионных реакций ≥3 степени тяжести во время цикла 1, препарат Газива® может вводиться в виде короткой (приблизительно 90 мин) инфузии, начиная с цикла 2 и далее (см. таблицу 8).
Таблица 7. Введение препарата Газива® при ФЛ
| День цикла терапии | Доза препарата Газива® | Скорость инфузии (рекомендации по купированию ИР, возникающих во время введения, указаны в таблице 11) | |
| Цикл 1 | День 1 | 1000 мг | 50 мг/ч. Скорость инфузии может быть постепенно увеличена с шагом 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. |
| День 8 | 1000 мг | Если во время предыдущей инфузии (конечная скорость инфузии ≥100 мг/ч) ИР не возникло или развилась ИР 1 степени тяжести, начальная скорость инфузии может быть 100 мг/ч и затем постепенно увеличиваться с шагом 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. Если во время предыдущей инфузии ИР ≥2 степени тяжести, скорость инфузии должна составлять 50 мг/ч. Скорость инфузии может быть постепенно увеличена с шагом 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. | |
| День 15 | 1000 мг | ||
| Циклы 2-6 или 2-8 | День 1 | 1000 мг | |
| Поддерживающая терапия | 1 раз в 2 мес, не более 2 лет или до прогрессирования заболевания | 1000 мг | |
Режим дозирования циклофосфамида, винкристина, доксорубицина и преднизолона при ранее нелеченной фолликулярной лимфоме
Необходимо следовать рекомендациям по дозированию циклофосфамида, винкристина, доксорубицина и преднизолона (стандартные схемы CHOP и CVP), представленным в одобренных инструкциях по медицинскому применению данных препаратов и в специальной литературе.
Таблица 8. Введение препарата Газива® короткими инфузиями при ФЛ
| День цикла терапии | Доза препарата Газива® | Скорость инфузии (рекомендации по купированию инфузионных реакций, возникающих во время введения, указаны в таблице 11) | |
| Циклы 2-6 или 2-8 | День 1 | 1000 мг | Если во время цикла 1 не возникло ИР ≥3 степени тяжести: 100 мг/ч в течение 30 мин, затем 900 мг/ч в течение приблизительно 60 мин. Если во время предыдущей короткой инфузии развилась ИР 1-2 степени тяжести с продолжающимися симптомами или ИР 3 степени тяжести, то необходимо вводить препарат Газива® со стандартной скоростью (см. таблицу 11). |
| Поддерживающая терапия | 1 раз в 2 мес, не более 2 лет или до прогрессирования заболевания | 1000 мг | |
Пропуск дозы (ФЛ)
При пропуске запланированной дозы препарата Газива® необходимо ввести препарат как можно раньше; не следует ждать следующего запланированного введения или исключать пропущенную дозу.
Если проявления токсичности развиваются перед днем 8 или днем 15 цикла 1 и возникает необходимость отложить введение, необходимо дождаться разрешения симптомов и после этого ввести соответствующую дозу. В таких случаях с учетом возникшей задержки должны быть перенесены все последующие визиты и начало цикла 2.
Во время поддерживающей терапии для введения последующих доз следует придерживаться изначального графика введения препарата.
Волчаночный нефрит
Рекомендуемая доза препарата Газива® составляет 1000 мг в/в как указано в таблице 9.
Таблица 9. Доза и скорость инфузии препарата Газива® для пациентов с ВН
| Номер дозы | Интервал лечения | Доза препарата Газива® | Скорость инфузии |
| 1 | Начальная инфузия | 1000 мг | 50 мг/ч. Скорость инфузии может быть увеличена с шагом 50 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. Информация о лечении при развитии ИР во время инфузии представлена в таблице 12. |
| 2 | Неделя 2 (через две недели после дозы 1) | 1000 мг | 100 мг/ч. Скорость инфузии может быть увеличена с шагом 100 мг/ч каждые 30 мин до максимальной скорости 400 мг/ч. |
| 3 | Неделя 24 | 1000 мг | |
| 4 | Неделя 26 (через две недели после дозы 3) | 1000 мг | |
| 5* и последующие | 1 раз в 6 мес | 1000 мг |
*Дозу 5 следует ввести через шесть месяцев после дозы 4.
У пациентов без ИР ≥ 3 степени тяжести во время предыдущих инфузий, препарат Газива® можно вводить короткими инфузиями (приблизительно 90 мин), начиная с дозы 2 и далее (см. таблицу 10) с сохранением премедикации.
Таблица 10. Введение препарата Газива® короткими инфузиями при ВН
| Номер дозы | Скорость инфузии |
| 1 | См. таблицу 9 |
| 2 и последующие (при отсутствии ИР ≥ 3 степени тяжести во время предыдущей инфузии) | 100 мг/ч в течение 30 мин, затем 900 мг/ч в течение приблизительно 60 мин. Если во время предыдущей короткой инфузии развилась ИР 1-2 степени тяжести с продолжающимися симптомами или ИР ≥ 3 степени тяжести, то необходимо вводить препарат Газива® со стандартной скоростью (см. таблицу 9). |
Пропуск дозы (волчаночный нефрит)
При пропуске запланированной дозы препарата Газива® необходимо ввести препарат как можно раньше; не следует ждать следующего запланированного введения. Далее график применения препарата следует скорректировать для сохранения соответствующего интервала между дозами.
Коррекция дозы (все показания)
Изменение дозы препарата Газива® не рекомендуется.
Рекомендации по изменению режима дозирования при возникновении симптоматических нежелательных явлений (включая инфузионные реакции) представлены в таблицах 11 и 12, и в разделе "Особые указания".
Таблица 11. Рекомендации по коррекции скорости инфузии при развитии инфузионных реакций (также см. раздел "Особые указания")
| 4 степень (жизнеугрожающие ИР) | Остановить инфузию и полностью прекратить терапию. |
| 3 степень (тяжелые ИР) | Временно прекратить инфузию и провести симптоматическую терапию. - При развитии ИР 3 степени при стандартной скорости инфузии после разрешения симптомов возобновить инфузию со скоростью в 2 раза ниже, чем скорость предыдущей инфузии (скорость, с которой вводился препарат в то время, когда развились ИР). В дальнейшем при отсутствии каких-либо симптомов ИР скорость инфузии можно повышать с шагом и интервалом, рекомендованными в таблицах 6 при ХЛЛ и 7 при ФЛ. - При развитии ИР 3 степени у пациентов с ФЛ при короткой инфузии после разрешения симптомов возобновить инфузию со скоростью в два раза ниже, чем скорость предыдущей инфузии (скорость, с которой вводился препарат в то время, когда развились ИР) и не более чем 400 мг/ч. Если инфузия завершается без повторного развития ИР 3 степени, то следующую инфузию необходимо проводить со стандартной скоростью. - В первом цикле терапии для пациентов с ХЛЛ, получающих первую дозу препарата Газива®, разделенную на 2 дня, в день 1 скорость инфузии можно увеличить через час после разрешения симптомов ИР, но не более чем до 25 мг/ч. При повторном развитии ИР 3 степени тяжести инфузию следует остановить и полностью прекратить терапию. |
| 1-2 степень (ИР легкой и средней степени) | Снизить скорость инфузии и провести симптоматическую терапию. После разрешения симптомов продолжить инфузию. Если у пациента отсутствуют симптомы ИР, скорость инфузии можно увеличивать с шагом и интервалом, рекомендованными в таблицах 6, 7 и 8. - В первом цикле терапии для пациентов с ХЛЛ, получающих первую дозу препарата Газива®, разделенную на 2 дня, в день 1 скорость инфузии можно увеличить через час после разрешения симптомов ИР, но не более чем до 25 мг/ч. |
Таблица 12. Рекомендации по коррекции скорости инфузии при развитии ИР у пациентов с ВН (также см. раздел "Особые указания")
| 4 степень (жизнеугрожающие) | Остановить инфузию и полностью прекратить терапию. |
| 3 степень (тяжелые) | Временно прекратить инфузию и провести симптоматическую терапию. - При развитии ИР 3 степени тяжести при стандартной скорости инфузии после разрешения симптомов возобновить инфузию со скоростью как минимум в 2 раза ниже, чем скорость предыдущей инфузии (скорость, с которой вводился препарат в то время, когда развились ИР). В дальнейшем при отсутствии каких-либо симптомов ИР скорость инфузии можно повышать с шагом и интервалом, которые применимы для используемой терапевтической дозы. - При повторном развитии ИР 3 степени тяжести инфузию следует остановить и полностью прекратить терапию. |
| 1-2 степень (ИР легкой и средней степени тяжести) | Снизить скорость инфузии в два раза относительно скорости, которая была на момент развития реакции, и провести симптоматическую терапию. - После разрешения симптомов следует продолжать инфузию со сниженной скоростью в течение еще 30 мин. - Если у пациента отсутствуют какие-либо симптомы ИР скорость инфузии можно повышать с шагом и интервалом, которые применимы для используемой терапевтической дозы. |
Особые группы пациентов
Коррекции дозы у пациентов ≥65 лет с ХЛЛ и ФЛ не требуется. Безопасность и эффективность препарата Газива® у пациентов ≥ 65 лет с ВН на данный момент не установлены.
Коррекции дозы препарата Газива® у пациентов с нарушением функции почек легкой и средней степени тяжести не требуется. Безопасность и эффективность препарата Газива® у пациентов с ХЛЛ, ФЛ и ВН с нарушением функции почек тяжелой степени тяжести формально не изучались.
.Эффективность и безопасность препарата Газива® у пациентов с нарушением функции печени не установлены.
Эффективность и безопасность препарата Газива® у детей и подростков младше 18 лет на данный момент не установлены. Данные отсутствуют.
Инструкция по приготовлению раствора для инфузий
Подготовка препарата к введению должна проводиться в асептических условиях, т.к. препарат Газива® не содержит антимикробных консервантов.
Следует использовать стерильную иглу и шприц для приготовления раствора для инфузий препарата Газива®.
Для введения препарата Газива® следует использовать только 0.9% раствор натрия хлорида.
Не следует использовать другие растворители, в частности раствор декстрозы (5%).
Для введения первой дозы (1000 мг) препарата Газива® в первом цикле ХЛЛрекомендуется использовать 2 инфузионных пакета из ПВХ или полиолефина (не-ПВХ) разного размера, что позволит различать дозу 100 мг, предназначенную для введения в цикле 1 в день 1, и дозу 900 мг для введения в цикле 1 в день 1 или день 2 (см. таблицу 13).
Из флакона отобрать 40 мл концентрата препарата Газива®.
Ввести 4 мл концентрата в инфузионный пакет объемом 100 мл, а оставшиеся 36 мл концентрата - в инфузионный пакет объемом 250 мл, содержащий стерильный апирогенный 0.9% раствор натрия хлорида. Промаркировать каждый инфузионный пакет.
Таблица 13.
| Доза препарата Газива®, предназначенная для введения | Необходимое количество концентрата препарата Газива® | Объем инфузионного пакета |
| 100 мг | 4 мл | 100 мл |
| 900 мг | 36 мл | 250 мл |
| 1000 мг | 40 мл | 250 мл |
Введение препарата Газива® в день 8 и день 15 цикла 1 и в день 1 циклов 2-6 терапии хронического лимфолейкоза, во все циклы терапии фолликулярной лимфомы и на протяжении всей терапии волчаночного нефрита
Из флакона отобрать 40 мл концентрата препарата Газива® и ввести в инфузионный пакет из ПВХ или полиолефина (не-ПВХ), содержащий стерильный апирогенный 0.9% раствор натрия хлорида.
Пакет следует осторожно перевернуть для перемешивания раствора, избегая избыточного образования пены.
Следует визуально проверить приготовленный раствор для инфузий на предмет механических включений и изменения окраски.
С точки зрения микробиологической чистоты приготовленный раствор для инфузии следует использовать немедленно. В исключительных случаях приготовленный раствор может храниться не более 24 ч при температуре от 2° до 8°C, если приготовление раствора для инфузий происходило в контролируемых и валидированных асептических условиях. При этом за условия хранения (правила хранения и продолжительность) отвечает специалист, готовивший раствор.
Приготовленный раствор препарата Газива® физически и химически стабилен в течение 24 ч при температуре от 2° до 8°С, затем в течение 24 ч при комнатной температуре (≤30°С) и затем в течение не более 24 ч, во время которых должна быть завершена инфузия.
Побочное действие
Хронический лимфолейкоз и фолликулярная лимфома
Нежелательные реакции, описанные в этом разделе, возникали во время индукционной терапии, поддерживающей терапии и последующего наблюдения пациентов с иНХЛ, включая ФЛ; лечения и последующего наблюдения пациентов с ХЛЛ в трех опорных клинических исследованиях:
- BO21004/CLL11 (N = 781): пациенты с ранее нелеченным ХЛЛ;
- BO21223/GALLIUM (N = 1390): пациенты с ранее нелеченной иНХЛ (у 86% пациентов имелась ФЛ);
- GAO4753g/GADOLIN (N = 409): пациенты с иНХЛ (у 81% пациентов имелась ФЛ), которые не ответили на лечение или у которых наблюдалось прогрессирование во время лечения или в течение 6 месяцев после завершения лечения ритуксимабом или по схеме, включающей ритуксимаб.
В данных исследованиях изучалось применение препарата Газива® в комбинации с хлорамбуцилом для лечения ХЛЛ и в комбинации с бендамустином, схемой CHOP или CVP с проведением последующей поддерживающей терапии препаратом Газива® при иНХЛ. В исследования BO21223/GALLIUM и GAO4753g/GADOLIN были включены пациенты с иНХЛ, включая ФЛ. В связи с этим для получения наиболее полной информации по безопасности во всей исследуемой популяции (т. е. иНХЛ) был проведен анализ нежелательных реакций, результаты которого представлены ниже.
В таблице 9 представлены сводные данные из опорных исследований (BO21004/CLL11, BO21223/GALLIUM GAO4753g/GADOLIN) по нежелательным реакциям, которые возникали с более высокой частотой (различие ≥ 2%), чем в соответствующей группе сравнения как минимум в одном из опорных исследований:
- у пациентов с ХЛЛ, получавших препарат Газива® в комбинации с хлорамбуцилом, в сравнении с монотерапией хлорамбуцилом или терапией ритуксимабом и хлорамбуцилом (исследование BO21004/CLL11);
- у пациентов с ранее нелеченной иНХЛ, получавших препарат Газива® в комбинации с химиотерапией (бендамустин, CHOP, CVP), у достигших ответа пациентов, получавших последующую поддерживающую терапию препаратом Газива®, в сравнении с комбинацией ритуксимаба и химиотерапии и последующей поддерживающей терапией ритуксимабом у достигших ответа пациентов (исследование BO21223/GALLIUM);
- пациентов с иНХЛ, не ответивших на лечение или у которых развилось прогрессирование заболевания во время лечения или в течение 6 месяцев после завершения лечения ритуксимабом или по содержащей ритуксимаб схеме, получавших препарат Газива® в комбинации с бендамустином, впоследствии у некоторых пациентов проводилась поддерживающая терапия препаратом Газива® в сравнении с монотерапией бендамустином (исследование GAO4753g/GADOLIN).
Наиболее серьезными нежелательными реакциями являлись:
- инфузионные реакции, наиболее часто встречавшиеся у пациентов с ХЛЛ (см. раздел "Особые указания");
- синдром лизиса опухоли, наиболее часто встречавшийся у пациентов с высокой опухолевой нагрузкой и/или высоким содержанием лимфоцитов в периферической крови и/или нарушением функции почек;
- тромбоцитопения, в некоторых случаях имевшая летальный исход в цикле 1.
Наиболее часто встречающимися нежелательным реакциями у пациентов независимо от заболевания были инфузионные реакции, нейтропения, диарея, запор и кашель.
В таблице 14 представлены нежелательные реакции, связанные с применением препарата Газива® в комбинации с различными режимами химиотерапии и по различным показаниям. Для описания частоты нежелательных реакций используются следующие категории: очень часто (≥1/10), часто (≥1/100, но <1/10) и нечасто (≥1/1000, но <1/100).
Нежелательные реакции отнесены к той или иной категории на основании наиболее высокой частоты (различие ≥ 2% по сравнению с соответствующей группой сравнения), которая наблюдалась в любом из основных клинических исследований препарата Газива®.
Нежелательные реакции сгруппированы в соответствии с системно-органной классификацией MedDRA.
Таблица 14. Нежелательные реакции у пациентов с ХЛЛ и ФЛ
| Нежелательная реакция (MedDRA) Системно-органный класс | Степени 3-5,% | Все степени,% | Категория частоты (все степени) |
| Инфекции и инвазии | |||
| Инфекция верхних дыхательных путей | 2.0 | 22.1 | Очень часто |
| Синусит | 1.0 | 12.3 | Очень часто |
| Опоясывающий лишай (Herpes Zoster) | 1.6 | 11.0 | Очень часто |
| Пневмония | 5.4 | 10.9 | Очень часто |
| Инфекция мочевыводящих путей | 2.9 | 11.8 | Очень часто |
| Ринит | < 1 | 8.3 | Часто |
| Назофарингит | < 1 | 10.8 | Очень часто |
| Фарингит | 0 | 4.3 | Часто |
| Герпес слизистой оболочки полости рта | < 1 | 6.3 | Часто |
| Грипп | < 1 | 5.2 | Часто |
| Легочная инфекция | 2.5 | 4.4 | Часто |
| Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы) | |||
| Плоскоклеточная карцинома кожи | 1.2 | 2.1 | Часто |
| Базальноклеточная карцинома | 1.0 | 2.9 | Часто |
| Со стороны крови и лимфатической системы | |||
| Нейтропения | 46.8 | 50.7 | Очень часто |
| Тромбоцитопения | 11.2 | 15.4 | Очень часто |
| Анемия | 6.9 | 12.4 | Очень часто |
| Лейкопения | 8.7 | 12.5 | Очень часто |
| Фебрильная нейтропения | 6.6 | 7.0 | Часто |
| Со стороны обмена веществ | |||
| Гипокалиемия | 1.0 | 7.4 | Часто |
| СЛО | 1.8 | 4.2 | Часто |
| Гиперурикемия | < 1 | 3.7 | Часто |
| Психические нарушения | |||
| Бессонница | < 1 | 14.3 | Очень часто |
| Тревожность | < 1 | 6.2 | Часто |
| Депрессия | < 1 | 4.7 | Часто |
| Со стороны нервной системы | |||
| Головная боль | < 1 | 16.8 | Очень часто |
| Со стороны сердца | |||
| Фибрилляция предсердий | 1.1 | 2.6 | Часто |
| Со стороны сосудов | |||
| Артериальная гипертензия | 1.7 | 6.2 | Часто |
| Со стороны дыхательной системы | |||
| Кашель | < 1 | 30.8 | Очень часто |
| Боль в ротоглотке | < 1 | 9.6 | Часто |
| Заложенность носа | 0 | 7.4 | Часто |
| Ринорея | 0 | 3.9 | Часто |
| Со стороны ЖКТ | |||
| Запор | < 1 | 32.4 | Очень часто |
| Диарея | 2.5 | 28.4 | Очень часто |
| Диспепсия | 0 | 8.6 | Часто |
| Геморрой | < 1 | 2.5 | Часто |
| Со стороны кожи и подкожных тканей | |||
| Алопеция | 0 | 12.6 | Очень часто |
| Зуд | < 1 | 10.6 | Очень часто |
| Экзема | 0 | 2.9 | Часто |
| Со стороны костно-мышечной системы и соединительной ткани | |||
| Артралгия | < 1 | 15.9 | Очень часто |
| Боль в спине | < 1 | 13.5 | Очень часто |
| Боль в конечностях | 1.0 | 10.3 | Очень часто |
| Боль в костях | < 1 | 5.3 | Часто |
| Скелетно-мышечные боли в грудной клетке | < 1 | 2.5 | Часто |
| Со стороны почек и мочевыводящих путей | |||
| Дизурия | < 1 | 2.7 | Часто |
| Недержание мочи | < 1 | 2.9 | Часто |
| Общие нарушения | |||
| Пирексия | 2.4 | 20.3 | Очень часто |
| Астения | 1.0 | 11.8 | Очень часто |
| Боль в груди | < 1 | 5.4 | Часто |
| .Утомляемость | 2.5 | 34.0 | Очень часто |
| Лабораторные и инструментальные данные | |||
| Снижение числа нейтрофилов | 2.1 | 2.1 | Часто |
| Увеличение массы тела | 0 | 2.1 | Часто |
| Снижение числа лейкоцитов | 2.1 | 2.1 | Часто |
| Травмы, интоксикации и осложнения процедур | |||
| ИР* | 21.2 | 71.6 | Очень часто |
* Определяется как любое связанное с терапией нежелательное явление, возникшее во время или в течение 24 часов после инфузии.
Описание отдельных нежелательных реакций
Инфузионные реакции
Наиболее часто (≥5%) наблюдались следующие симптомы инфузионных реакций (ИР): тошнота, рвота, диарея, головная боль, головокружение, утомляемость, озноб, пирексия, артериальная гипотензия, "приливы", артериальная гипертензия, тахикардия, одышка и дискомфорт в области грудной клетки. Кроме того, сообщалось о симптомах ИР со стороны дыхательной системы, таких как бронхоспазм, раздражение горла и гортани, хрипы, отек гортани и со стороны сердца - фибрилляция предсердий
Хронический лимфолейкоз
Частота ИР составляет 65% при введении первой дозы (1000 мг). У 20% пациентов наблюдались ИР 3-4 степени тяжести. У 7% пациентов ИР послужили причиной прекращения лечения препаратом Газива®. Частота ИР при последующих введениях составила соответственно 3% после второй дозы препарата Газива® (1000 мг) и 1% после введения последующих доз. ИР 3-4 степени тяжести наблюдались только при введении первых 1000 мг препарата Газива®. При последующих введениях ИР 3-5 степени не наблюдалось.
Комплекс мер по предупреждению ИР (см. раздел "Режим дозирования") позволяет снизить частоту ИР за исключением ИР 3-4 степени тяжести. Показатели ИР 3-4 степени тяжести (которые наблюдались у относительно небольшого числа пациентов) были аналогичными до и после принятия мер по снижению риска развития ИР.
Неходжкинская лимфома
В цикле 1 общая частота возникновения ИР была выше у пациентов, получавших препарат Газива® в комбинации с химиотерапией, по сравнению с пациентами из соответствующих групп сравнения. У пациентов, получавших препарат Газива® в комбинации с химиотерапией, частота возникновения ИР была самой высокой в день 1, постепенно снижалась при последующих инфузиях и продолжала снижаться во время поддерживающей монотерапии препаратом Газива®.
В целом у 4% пациентов развились ИР, послужившие причиной прекращения лечения препаратом Газива®.
В клиническом исследовании МО40597, разработанном для изучения профиля безопасности коротких (приблизительно 90 мин) инфузий после цикла 1 у пациентов с ранее нелеченной ФЛ, частота, тяжесть и типы симптомов ИР были аналогичны тем, что наблюдались у пациентов, получавших инфузии со стандартной скоростью введения.
Нейтропения и инфекции
Хронический лимфолейкоз
Частота развития нейтропении была выше в группе терапии препаратом Газива® в комбинации с хлорамбуцилом (41%), чем в группе терапии ритуксимабом в комбинации с хлорамбуцилом. Нейтропения разрешалась спонтанно или после терапии гранулоцитарным колониестимулирующим фактором. Частота развития инфекций составила 38% в группе терапии препаратом Газива® в комбинации с хлорамбуцилом и 37% в группе терапии ритуксимабом в комбинации с хлорамбуцилом (явления 3-5 степени тяжести зарегистрированы у 12% и 14% пациентов, соответственно, а случаи летального исхода - менее чем у 1% пациентов в обеих группах). Также сообщалось о случаях длительной нейтропении (2% в группе комбинации препарата Газива® и хлорамбуцила и 4% в группе комбинации ритуксимаба и хлорамбуцила) и нейтропении с поздней манифестацией (16% в группе комбинации препарата Газива® и хлорамбуцила и 12% в группе комбинации ритуксимаба и хлорамбуцила).
Неходжкинская лимфома
Нейтропения возникала чаще у пациентов, получавших лечение препаратом Газива® в комбинации с химиотерапией, по сравнению с пациентами из контрольных популяций, а риск ее развития был повышен в периоде индукции.
Частота длительной нейтропении и нейтропении с поздним началом при лечении препаратом Газива® и химиотерапией составляла соответственно 3% и 7%.
Частота возникновения инфекций составляла 78% при лечении препаратом Газива® в комбинации с химиотерапией (явления 3-5 степени тяжести отмечались у 22%, и летальные исходы зарегистрированы у 3% пациентов).
Среди пациентов, получивших профилактическое лечение гранулоцитарным колониестимулирующим фактором, инфекции 3-5 степени тяжести встречались реже.
Тромбоцитопения и кровотечения
Хронический лимфолейкоз
Частота развития тромбоцитопении была выше на фоне терапии препаратом Газива® в комбинации с хлорамбуцилом по сравнению с группой терапии ритуксимаба в комбинации с хлорамбуцилом, в частности во время цикла 1. Острая тромбоцитопения, развивающаяся в течение 24 часов после инфузии, наблюдалась у 4% пациентов в группе терапии препаратом Газива® в комбинации с хлорамбуцилом (см. раздел "Особые указания"). Общая частота кровотечений была сходной в группе препарата Газива® и в группе ритуксимаба. Количество летальных исходов было сбалансировано между группами лечения, однако летальные случаи кровотечений на фоне терапии препаратом Газива® регистрировались только в первом цикле терапии. Причинно-следственная связь между тромбоцитопенией и развитием кровотечений не установлена.
Неходжкинская лимфома
Тромбоцитопения возникала с повышенной частотой в цикле 1 при лечении препаратом Газива® в комбинации с химиотерапией. Тромбоцитопения, развивающаяся в течение инфузии или не позднее 24 ч после инфузии (острая тромбоцитопения), чаще наблюдалась у пациентов, получавших терапию препаратом Газива® в комбинации с химиотерапией, чем у пациентов из групп сравнения. Частота нежелательных явлений кровотечений была схожей во всех группах лечения. Частота кровотечений всех степеней тяжести и кровотечений 3-5 степени тяжести составила 12% и 4%, соответственно. Частота случаев кровотечений с летальным исходом составила менее 1%, при этом в цикле 1 таких явлений не возникало.
Нарушения коагуляции, включая ДВС-синдром
Сообщалось о случаях развития ДВС-синдрома у пациентов с ФЛ и ХЛЛ, получавших терапию препаратом Газива®. В некоторых случаях явления были связаны с ИР и/или СЛО. Специфичных исходных факторов риска развития ДВС-синдрома выявлено не было. Сообщалось о 2 пациентах, у которых развился ДВС-синдром (у одного пациента – серьезное явление, у одного – несерьезное) среди 1135 пациентов, получавших терапию препаратом Газива® в трех крупнейших контролируемых исследованиях терапии ФЛ и ХЛЛ, спонсированных компанией (CLL11/BO21004, GALLIUM/BO21223, GADOLIN/GO01297/GAO4753g). Все явления были отмечены в группе терапии обинутузумабом, в группах сравнения ни одного явления зарегистрировано не было. Все явления произошли в течение 1-2 дней после первой инфузии. Все пациенты продолжили лечение.
Прогрессирующая мультиочаговая лейкоэнцефалопатия (ПМЛ)
Прогрессирующая мультиочаговая лейкоэнцефалопатия зарегистрирована у пациентов, получавших препарат Газива®.
Реактивация вируса гепатита В
Сообщалось о случаях реактивации вируса гепатита В на фоне терапии препаратом Газива®.
Прогрессирование сопутствующих заболеваний сердца
На фоне терапии препаратом Газива® наблюдались случаи нарушения функции сердца, в т.ч. с летальным исходом.
Перфорация органов ЖКТ
Сообщалось о случаях перфорации органов ЖКТ у пациентов, получающих препарат Газива®, преимущественно по поводу неходжкинской лимфомы.
Поддерживающая терапия у пациентов с индолентной НХЛ
В исследовании GAO4753g пациенты в группе терапии бендамустином получали только индукционную терапию в течение 6 месяцев, в то время как пациенты в группе комбинации препарата Газива® и бендамустина после периода индукционной терапии продолжили применение препарата Газива® в качестве поддерживающей терапии. В период поддерживающей терапии препаратом Газива® самыми частыми нежелательными реакциями были кашель (20.3%), нейтропения (12.7%), инфекции верхних дыхательных путей (12.0%), диарея (10.1%), бронхит (9.5%), синусит (9.5%), тошнота (8.9%), утомляемость (8.9%), ИР (8.2%), инфекция мочевыводящих путей (7.0%), назофарингит (7.0%), пирексия (7.0%), артралгия (6.3%), рвота (5.7%), сыпь (5.7%), пневмония (5.1%), одышка (5.1%) и боли в конечностях (5.1%). Самыми частыми нежелательными реакциями 3-5 степени тяжести были нейтропения (10.8%), фебрильная нейтропения (1.9%) и анемия, тромбоцитопения, пневмония, сепсис, инфекция верхних дыхательных путей и инфекция мочевыводящих путей (все с частотой 1.3%).
Изменения лабораторных показателей
Транзиторное повышение активности печеночных ферментов (АСТ, АЛТ, ЩФ) в сыворотке крови наблюдалось вскоре после первой инфузии препарата Газива®.
Волчаночный нефрит
Безопасность и эффективность препарата Газива® у пациентов с ВН класса III или IV с сопутствующим ВН класса V или без него согласно классификации Международного общества нефрологии и Общества патологии почек (ISN/RPS) 2003 г. были оценены в исследовании REGENCY и подтверждены клиническими данными, полученными в исследовании NOBILITY, до недели 76.
Исследование REGENCY (CA41705) - это исследование III фазы, в которое было включено 136 пациентов, получавших лечение препаратом Газива® в комбинации со стандартной терапией микофенолата мофетилом (ММФ) и ГКС.
Исследование NOBILITY (WA29748) - это исследование II фазы, в которое было включено 64 пациента, получавших лечение препаратом Газива® в комбинации со стандартной терапией ММФ/микофеноловой кислотой (МФК) и ГКС.
Наиболее часто наблюдаемыми нежелательными реакциями в клинических исследованиях у пациентов, получавших препарат Газива® для лечения ВН, были инфекция верхних дыхательных путей, коронавирусная инфекция (COVID-19) и инфекция мочевыводящих путей.
В таблице 15 представлены нежелательные реакции, связанные с применением препарата Газива® в комбинации со стандартной терапией. Нежелательные реакции, перечисленные в этой таблице, относятся к следующим категориям: очень часто (≥1/10), часто (≥1/100, но <1/10) и нечасто (≥1/1000, но <1/100).
Таблица 15. Нежелательные реакции у пациентов с ВН
| Нежелательная реакция (MedDRA) Системно-органный класс | Степени 3-5,% | Все степени,% | Категория частоты (все степени) |
| Инфекции и инвазии | |||
| Инфекция верхних дыхательных путей | 0 | 29 | Очень часто |
| COVID-19 | 5.0 | 22.5 | Очень часто |
| Инфекция мочевыводящих путей | 3.0 | 21.0 | Очень часто |
| Бронхит | 0 | 14 | Очень часто |
| Пневмония | 2.0 | 9.5 | Часто |
| Простой герпес | 0 | 2.5 | Часто |
| Травмы, интоксикации и осложнения процедур | |||
| ИР | 1.5 | 13.5 | Очень часто |
| Со стороны крови и лимфатической системы | |||
| Нейтропения | 7 | 14 | Очень часто |
Описание отдельных нежелательных реакций
Инфекции
Частота развития инфекций составила 72.0% в группе терапии препаратом Газива и 61.7% в группе плацебо. Наиболее часто отмечавшимися инфекциями были инфекции верхних и нижних дыхательных путей. Частота развития инфекций 3-5 степени тяжести составила 11.5% в группе терапии препаратом Газива® и 9.8% в группе плацебо. Инфекции с летальным исходом отмечались у 1% пациентов в группе терапии препаратом Газива® и у 0.5% пациентов в группе плацебо.
Нейтропения
Нейтропения и связанные с ней явления отмечались у 14.0% пациентов в группе терапии препаратом Газива®, в сравнении с 6.2% пациентов в группе плацебо. Нейтропения 3-4 степени тяжести отмечалась у 7% пациентов, получавших лечение препаратом Газива®, в сравнении с 0.5% пациентов в группе плацебо. В большинстве случаев нейтропении и связанных с ней
явлений разрешение/улучшение наступило спонтанно или после терапии гранулоцитарным
колониестимулирующим фактором (см. раздел 4.4).
Инфузионные реакции
ИР отмечались у 13.5% пациентов в группе терапии препаратом Газива® в сравнении с 10.4% пациентов в группе плацебо. В обеих группах ИР были преимущественно 1-2 степени тяжести и развивались во время/после первой инфузии. ИР 3-4 степени тяжести отмечались у 1.5% пациентов в группе терапии препаратом Газива® в сравнении с 0.5% пациентов в группе плацебо. Все явления 3-4 степени тяжести развились во время/после первой или второй инфузии. Частота новых случаев и степень тяжести ИР снижались при последующих инфузиях. ИР 5 степени тяжести не наблюдалось.
В исследовании REGENCY наиболее частыми признаками/симптомами ИР были головная боль, тошнота и рвота. В исследовании NOBILITY наиболее частыми симптомами ИР были пирексия и тахикардия.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск" лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к обинутузумабу и к другим вспомогательным веществам, входящим в состав препарата;
- беременность;
- период грудного вскармливания;
- возраст до 18 лет (эффективность и безопасность применения у детей не установлены).
С осторожностью
Хронические и рецидивирующие инфекции в анамнезе.
Применение при беременности и кормлении грудью
Женщины с детородным потенциалом (контрацепция у мужчин и женщин)
Женщины с детородным потенциалом должны использовать надежные методы контрацепции во время лечения препаратом Газива® и в течение 18 месяцев после завершения терапии.
Беременность
Препарат Газива® не следует назначать беременным женщинам, если возможная польза для матери не превышает потенциальный риск для плода.
Необходимо рассмотреть отсрочку проведения вакцинации живыми вакцинами у младенцев, чьи матери получали препарат Газива® во время беременности до тех пор, пока число B-клеток у них не восстановится до нормы.
Исследований у беременных женщин не проводилось. Исследование репродуктивной функции у яванских макак не выявило признаков проявления эмбриофетальной токсичности или тератогенного действия, однако привело к полному истощению пула B-лимфоцитов у потомства. Количество B-клеток у потомства вернулось к нормальным уровням, а функция иммунной системы восстановилась в течение 6 месяцев после рождения. Сывороточная концентрации обинутузумаба у потомства была такой же, как и у матерей на 28 день после родов, при этом концентрация в молоке в тот же день была очень низкой, в связи с чем можно предположить, что обинутузумаб проникает через плаценту.
Период грудного вскармливания
Поскольку человеческий иммуноглобулин G (IgG) проникает в грудное молоко человека, а степень всасывания и вредного воздействия на ребенка неизвестна, в период лечения и в течение 18 месяцев после применения последней дозы препарата Газива® грудное вскармливание следует прекратить.
Данные, полученные на животных, свидетельствуют о проникновении препарата Газива® в грудное молоко.
Применение при нарушениях функции печени
Противопоказано применение у пациентов с нарушениями функции печени (эффективность и безопасность применения не установлены).
Применение при нарушениях функции почек
Противопоказание: нарушения функции почек тяжелой степени при хроническом лимфолейкозе (КК < 30 мл/мин) и при фолликулярной лимфоме (КК < 40 мл/мин) (эффективность и безопасность применения не установлены).
Применение у детей
Применение у пожилых пациентов
Особые указания
В медицинской документации пациента следует указывать торговое название препарата (Газива®) и номер серии. Замена препарата на какой-либо другой биологический лекарственный препарат требует согласования с лечащим врачом. Информация, представленная в данном описании, относится только к препарату Газива®.
Терапию препаратом Газива® должен назначать онколог или гематолог. Введение препарата проводится при наличии доступа к набору для оказания экстренной помощи. Врач, имеющий опыт применения химиотерапевтических препаратов, должен быть доступен в процессе проводимой терапии.
Хронический лимфолейкоз и фолликулярная лимфома
Инфузионные реакции
Наиболее часто наблюдаемыми нежелательными реакциями у пациентов, получающих препарат Газива®, были ИР, развившиеся преимущественно во время введения первых 1000 мг препарата.
Комплекс мер по предупреждению ИР (применение подходящего ГКС, перорального приема анальгетика/антигистаминного препарата, пропуск приема антигипертензивного препарата) у пациентов с ХЛЛ позволяет снизить частоту ИР, за исключением ИР 3-4 степени. Показатели ИР 3-4 степени (которые наблюдались у относительно небольшого числа пациентов) были аналогичными до и после принятия мер по снижению риска развития ИР.
Рекомендуется принимать меры по предупреждению ИР, описанные в разделе "Режим дозирования".
Частота и тяжесть ИР существенно уменьшались после введения первых 1000 мг препарата Газива®, и при последующих инфузиях ИР у большинства пациентов не развивались.
В основном, независимо от показаний, наблюдались ИР легкой и средней степени тяжести, которые разрешались после замедления или временного прекращения первой инфузии, тем не менее, известно также о тяжелых и жизнеугрожающих ИР, требующих симптоматической терапии. ИР могут клинически не отличаться от lgE-опосредованных аллергических реакций (например, анафилаксии). У пациентов с высокой опухолевой нагрузкой и/или с высоким содержанием циркулирующих лимфоцитов при ХЛЛ (>25х109/л) риск развития тяжелых ИР повышен. Меры по профилактике ИР описаны в разделе "Режим дозирования". Меры по купированию инфузионных реакций с учетом их степени тяжести у пациентов с ХЛЛ и ФЛ описаны в разделе "Режим дозирования", Таблица 5.
Терапию препаратом Газива® следует полностью прекратить, в случае развития:
- жизнеугрожающих острых респираторных симптомов;
- ИР 4 степени (угрожающих жизни);
- повторной (продолжающейся/рецидивирующей) ИР 3 степени (после возобновления первой инфузии или во время последующей инфузии).
Пациенты с сопутствующими заболеваниями сердца или легких должны находиться под тщательным наблюдением во время инфузии и после нее. Во время инфузии препарата Газива® возможно развитие артериальной гипотензии. В связи с этим следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 ч перед каждой инфузией, на протяжении каждой инфузии и в течение 1 ч после введения препарата. Необходимо оценить пользу и возможный риск остановки приема антигипертензивных препаратов у пациентов с высоким риском развития гипертонического криза.
Реакции гиперчувствительности
На фоне терапии препаратом Газива® отмечались случаи реакций гиперчувствительности с немедленным (анафилаксия) и замедленным (сывороточная болезнь) развитием.
Если во время или после инфузии подозревается развитие реакции гиперчувствительности (развитие симптомов происходит, как правило, при последующих введениях, очень редко симптомы развиваются во время первой инфузии), введение должно быть прекращено и терапию препаратом Газива® следует отменить и не возобновлять в дальнейшем.
Пациентам с установленной гиперчувствительностью к препарату Газива® противопоказана терапия данным препаратом. Возможны затруднения при дифференциальной диагностике реакции гиперчувствительности и ИР.
Синдром лизиса опухоли (СЛО)
Наблюдались случаи СЛО. Пациентам из группы риска развития СЛО (больные с высокой опухолевой нагрузкой и/или высоким содержанием лимфоцитов в периферической крови (>25×109/л) и/или с нарушением функции почек (КК <70 мл/мин)) необходимо провести профилактику СЛО. Профилактика должна включать адекватную гидратацию и назначение гипоурикемических препаратов (например, аллопуринола или других альтернативных препаратов, таких как препараты урат-оксидазного фермента, например, расбуриказа) до начала инфузии (как указано в разделе "Режим дозирования"). Пациенты из группы риска развития СЛО должны находиться под тщательным наблюдением в первые дни терапии, при этом особое внимание следует уделять контролю функции почек, концентрации калия и мочевой кислоты. Дополнительные мероприятия должны проводиться в соответствии со стандартной практикой. При развитии СЛО необходимо тщательное наблюдение за функцией почек и водно-электролитным балансом с последующей коррекцией электролитных нарушений, а также проведением поддерживающих лечебных мероприятий, включая, если требуется, диализ.
Нейтропения
Наблюдались случаи серьезной и жизнеугрожающей нейтропении, включая фебрильную нейтропению. При развитии нейтропении пациенты нуждаются в тщательном наблюдении и проведении регулярного лабораторного обследования до полного разрешения симптомов. При необходимости следует провести терапию в соответствии с локально принятой практикой и рассмотреть необходимость применения Г-КСФ. При любом проявлении сопутствующей инфекции необходимо назначить соответствующее лечение. Возможно развитие нейтропении с поздней манифестацией (возникновение не раньше чем через 28 дней после окончания лечения) и длительной нейтропении продолжительностью более 28 дней после окончания или отмены терапии.
Тромбоцитопения
Наблюдались случаи тяжелой и жизнеугрожающей тромбоцитопении, в т.ч. случаи острой тромбоцитопении, которые развивались в течение 24 ч после инфузии. В 1-м цикле терапии наблюдались случаи кровотечений с летальным исходом. Четкая взаимосвязь между развитием кровотечений и тромбоцитопенией не установлена.
В ходе лечения пациенты нуждаются в тщательном наблюдении на предмет развития тромбоцитопении, особенно в 1 цикле. При выявлении тромбоцитопении необходимо регулярное проведение лабораторного обследования до тех пор, пока реакция не разрешится. В тяжелых или жизнеугрожающих случаях следует рассмотреть возможность отложить введение препарата Газива®. Решение о проведении гемотрансфузии (трансфузии тромбоцитов) принимает лечащий врач в соответствии с практикой, установленной в лечебном учреждении. Необходимо принимать во внимание прием любых сопутствующих препаратов, способных усугубить тромбоцитопению, таких как ингибиторы агрегации тромбоцитов и антикоагулянты, особенно в 1 цикле терапии.
Нарушения коагуляции, включая ДВС-синдром
Сообщалось о случаях развития ДВС-синдрома у пациентов с ФЛ и ХЛЛ, получавших терапию препаратом Газива®. В большинстве случаев явления включали субклинические (бессимптомные) изменения лабораторных показателей тромбоцитов и коагулограммы после первой инфузии со спонтанным разрешением, как правило к 8 дню. В некоторых случаях явления были связаны с ИР и/или СЛО. Специфичных исходных факторов риска развития ДВС-синдрома выявлено не было (см. раздел "Побочное действие").
Прогрессирование сопутствующих заболеваний сердца
У пациентов с сопутствующими заболеваниями сердца, получавших терапию препаратом Газива®, отмечалось развитие аритмий (в частности, фибрилляции предсердий и тахиаритмии), стенокардии, острого коронарного синдрома, инфаркта миокарда и сердечной недостаточности (см. раздел "Побочное действие"). Данные явления могут развиться как часть инфузионных реакций и иметь летальный исход. Таким образом, пациентов с заболеваниями сердца в анамнезе следует тщательно мониторировать. Кроме того, у таких пациентов следует соблюдать осторожность при проведении гидратации с целью избежать потенциального образования избытка жидкости.
Инфекции
Препарат Газива® не следует применять при наличии у пациента инфекции в активной стадии. Следует соблюдать осторожность при принятии решения о назначении препарата Газива® пациентам с периодически рецидивирующими и хроническими инфекциями в анамнезе. Возможно развитие серьезных бактериальных и грибковых инфекций, а также развитие или реактивация вирусных инфекций во время терапии и после ее окончания. Сообщалось о летальных случаях инфекционных заболеваний.
У пациентов с ФЛ зарегистрирована высокая частота развития инфекций на всех этапах клинических исследований, включая периоды последующего наблюдения. При этом наиболее высокая частота инфекций была характерна для периода поддерживающей терапии.
В периоде последующего наблюдения инфекции 3-5 степеней тяжести чаще наблюдались у пациентов, которые на этапе индукции получали препарат Газива® в комбинации с бендамустином.
Реактивация вируса гепатита В
На фоне применения анти CD-20 препаратов возможна реактивация вируса гепатита В, в некоторых случаях сопровождающаяся фульминантным гепатитом, печеночной недостаточностью, возможен летальный исход.
Перед назначением препарата Газива® всем пациентам следует пройти скрининг на вирус гепатита В, включая определение HBsAg-статуса, HBcAb-статуса, а также дополнительных маркеров согласно установленной местной практике. Препарат Газива® не следует применять у пациентов с активным гепатитом В. Пациентам с положительными серологическими маркерами гепатита В следует проконсультироваться с врачом-гепатологом перед назначением препарата Газива®. В отношении таких пациентов необходимо проводить соответствующий мониторинг и принимать меры по профилактике реактивации вируса гепатита В в соответствии с местными стандартами.
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
У пациентов, получавших терапию препаратом Газива®, отмечалась ПМЛ (см. раздел "Побочное действие"). При развитии у пациентов новых неврологических симптомов или изменении уже имеющихся необходимо рассмотреть возможность диагноза ПМЛ. Симптомы ПМЛ не являются специфическими и могут варьировать в зависимости от локализации повреждения в головном мозге. Часто наблюдаются моторные симптомы с пирамидными нарушениями (например, мышечная слабость, паралич и нарушения чувствительности), аномалии чувствительности, мозжечковые нарушения и дефекты поля зрения. Могут развиться некоторые признаки/симптомы, считающиеся корковыми (например, афазия или визуально-пространственная дезориентация).
Диагностика ПМЛ включает, но не ограничивается консультацией врача-невролога, проведением МРТ головного мозга и люмбальной пункцией (анализ спинномозговой жидкости на содержание ДНК JC-вируса). Терапию препаратом Газива® необходимо приостановить на время проведения обследования потенциальной ПМЛ и полностью ее прекратить, если диагноз ПМЛ подтвержден. Также следует рассмотреть возможность прекращения или сокращения любой сопутствующей иммуносупрессивной терапии или химиотерапии. Для оценки и лечения ПМЛ пациент должен быть направлен к неврологу.
Иммунизация
Безопасность иммунизации живыми или аттенуированными противовирусными вакцинами после окончания терапии препаратом Газива® не изучалась, вакцинация живыми противовирусными вакцинами во время терапии и до момента восстановления пула В-клеток не рекомендуется.
Внутриутробное воздействие препарата Газива® и вакцинация младенцев живыми вирусными вакцинами
В связи с потенциальным истощением пула В-клеток у младенцев, чьи матери получали препарат Газива® во время беременности, вопрос о безопасности и сроках вакцинации живыми вирусными вакцинами следует обсудить с педиатром. Необходимо рассмотреть возможность отсрочки вакцинации живыми вакцинами до тех пор, пока число В-клеток у ребенка не восстановится до нормы.
Пациенты с нарушением функции почек
Хронический лимфолейкоз. В опорном исследовании у 27% пациентов (90/336) с ХЛЛ и нарушением функции почек средней степени тяжести (КК<50 мл/мин), получающих лечение препаратом Газива® в комбинации с хлорамбуцилом, частота развития серьезных нежелательных явлений и нежелательных явлений с летальным исходом может быть выше по сравнению с пациентами с КК ≥50 мл/мин. Значимых различий в эффективности между пациентами с КК <50 мл/мин и пациентами с КК ≥50 мл/мин не отмечалось. Применение препарата Газива® у пациентов с КК <30 мл/мин не изучалось.
Неходжкинская лимфома. В опорных исследованиях препарата Газива при индолентных неходжкинских лимфомах (иНХЛ) у 7.7% пациентов с рефрактерной/рецидивирующей ФЛ (GAO4753g, 14/204) и у 5% с ранее нелеченной ФЛ (BO21223, 35/698) имелось нарушение функции почек средней степени тяжести (КК<50 мл/мин). У этих пациентов развивалось большее число серьезных нежелательных реакций, ведущих к отмене терапии (только пациенты с ранее нелеченной фолликулярной лимфомой), и нежелательных реакций 3-5 степени тяжести по сравнению с пациентами с КК ≥50 мл/мин. Применение препарата Газива® у пациентов с КК <40 мл/мин не изучалось.
Пациенты с нарушением функции печени
Безопасность и эффективность препарата Газива® у пациентов с нарушением функции печени не изучались.
Волчаночный нефрит
Инфекции
Препарат Газива® не следует применять при наличии у пациента инфекции в активной стадии.
Следует соблюдать осторожность при принятии решения о назначении препарата Газива® пациентам с периодически рецидивирующими и хроническими инфекциями в анамнезе.
Возможно развитие серьезных бактериальных и грибковых инфекций, а также развитие или реактивация вирусных инфекций во время терапии и после ее окончания. Сообщалось о летальных случаях инфекционных заболеваний у пациентов, получавших препарат Газива® для лечения ВН.
Перед назначением препарата Газива® всем пациентам следует пройти скрининг на вирус гепатита В, включая определение HBsAg – статуса, HBcAb – статуса, а также дополнительных маркеров согласно установленной местной практике. Препарат Газива® не следует применять пациентам с активным гепатитом B. Пациентам с положительными серологическими маркерами гепатита B следует проконсультироваться с врачом-гепатологом перед назначением препарата Газива®. В отношении таких пациентов необходимо проводить соответствующий мониторинг и принимать меры по профилактике реактивации вируса гепатита B в соответствии с местными медицинскими стандартами.
Нейтропения
У пациентов, получающих препарат Газива® для лечения ВН, наблюдались случаи тяжелой и жизнеугрожающей нейтропении, включая фебрильную нейтропению. При развитии нейтропении пациенты нуждаются в тщательном наблюдении и проведении регулярных лабораторных исследований до полного разрешения явления. При необходимости следует провести терапию в соответствии с локально принятой практикой и рассмотреть необходимость применения Г-КСФ. При любом проявлении сопутствующей инфекции необходимо назначить соответствующее лечение.
Инфузионные реакции
ИР у пациентов с ВН развивались преимущественно во время введения первых 1000 мг препарата. ИР, как правило, были легкой (1 степень) или средней (2 степень) степени тяжести, и они разрешались после замедления или временного прекращения инфузии (см. таблицу 8).
Однако также были описаны тяжелые (3 степень) и жизнеугрожающие (4 степень) ИР, потребовавшие симптоматической терапии. Информация о профилактике ИР представлена в разделе "Режим дозирования".
Терапию препаратом Газива следует полностью прекратить в случае развития:
- жизнеугрожающих острых респираторных симптомов;
- ИР 4 степени тяжести (угрожающих жизни);
- повторной (продолжающейся/рецидивирующей) ИР 3 степени тяжести (после возобновления первой инфузии или во время последующей инфузии).
Пациенты с сопутствующими заболеваниями сердца или легких должны находиться под тщательным наблюдением во время инфузии и после нее. Во время инфузии препарата Газива® возможна артериальная гипотензия. В связи с этим следует рассмотреть возможность приостановки лечения антигипертензивными препаратами в течение 12 ч перед каждой инфузией, на протяжении каждой инфузии и в течение 1 ч после введения препарата.
Необходимо оценить пользу и возможный риск остановки приема антигипертензивных препаратов у пациентов с высоким риском развития гипертонического криза.
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
У пациентов, получавших препарат Газива для лечения ХЛЛ и ФЛ отмечалась ПМЛ. У пациентов, получавших препарат Газива® в объединенных плацебо-контролируемых исследованиях по лечению ВН, случаев ПМЛ не отмечалась. Терапию препаратом Газива® необходимо приостановить на время проведения обследования потенциальной ПМЛ и полностью ее прекратить, если диагноз ПМЛ подтвержден. Также следует рассмотреть возможность прекращения или сокращения любой сопутствующей иммуносупрессивной терапии или химиотерапии. Для оценки и лечения ПМЛ пациент должен быть направлен к врачу-неврологу.
Иммунизация
Безопасность иммунизации живыми или аттенуированными противовирусными вакцинами после окончания терапии препаратом Газива® не изучалась. Вакцинация живыми противовирусными вакцинами во время терапии и до момента восстановления пула B-клеток не рекомендуется.
Внутриутробное воздействие препарата Газива® и вакцинация младенцев живыми вакцинами
В связи с потенциальным истощением пула В-клеток у младенцев, чьи матери получали препарат Газива® во время беременности, вопрос о безопасности и сроках вакцинации живыми вирусными вакцинами следует обсудить с врачом педиатром. Необходимо рассмотреть возможность отсрочки вакцинации живыми вакцинами до тех пор, пока число B-клеток у ребенка не восстановится до нормы.
Пациенты пожилого возраста
Безопасность и эффективность препарата Газива® у пациентов в возрасте 65 лет или старше на данный момент не установлены.
Пациенты с нарушением функции почек
Анализ популяционной фармакокинетики препарата Газива® показал, что КК не оказывает влияния на фармакокинетику обинутузумаба у пациентов с ВН. Показатели фармакокинетики обинутузумаба у пациентов с нарушением функции почек легкой или средней степени тяжести были сходны с таковыми у пациентов с нормальной функцией почек. Безопасность и эффективность препарата Газива у пациентов с нарушением функции почек тяжелой степени формально не изучали..
Влияние на способность к управлению транспортными средствами и механизмами
Влияние препарата Газива® на способность управлять автомобилем и работать с механизмами не изучалось. При развитии инфузионных реакций и других нежелательных реакций рекомендуется воздержаться от управления транспортными средствами и механизмами до полного разрешения симптомов.
Передозировка
Симптомы: опыт превышения рекомендованной дозы препарата Газива® в клинических исследованиях отсутствует. В клинических исследованиях изучено применение доз от 50 мг до 2000 мг за одну инфузию. Степень тяжести и частота нежелательных реакций не зависели от дозы.
Лечение: при превышении дозы препарата Газива® необходимо немедленно прекратить инфузию или снизить дозу и тщательно наблюдать за пациентом. В связи с увеличением риска инфекционных осложнений при истощении пула В-лимфоцитов следует рассмотреть необходимость проведения развернутого общего анализа крови.
Лекарственное взаимодействие
Специальных исследований взаимодействия с другими лекарственными средствами не проводилось.
Однако были проведены ограниченные подысследования межлекарственного взаимодействия препарата Газива® с бендамустином, препаратами схемы CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон), препаратами схемы FC (флударабин, циклофосфамид) и хлорамбуцилом. Совместное введение препарата Газива® не оказывало влияния на фармакокинетику бендамустина, FC или отдельных компонентов схемы CHOP; кроме того, отсутствовало заметное влияние бендамустина, FC, хлорамбуцила или CHOP на фармакокинетику препарата Газива®. Риск взаимодействия с одновременно применяемыми препаратами нельзя полностью исключить.
Вакцинация живыми противовирусными вакцинами во время терапии и до момента восстановления пула В-клеток не рекомендуется из-за иммуносупрессивного эффекта обинутузумаба.
Условия хранения препарата Газива®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С. Не замораживать.
Срок годности препарата Газива®
Инструкции по уничтожению неиспользованного препарата или препарата с истекшим сроком годности
Попадание лекарственного препарата Газива® в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. Уничтожение неиспользованного препарата или препарата с истекшим сроком годности должно проводиться в соответствии с требованиями лечебного учреждения.
Условия реализации
Контакты для обращений
Ф.ХОФФМАНН-ЛЯ РОШ ЛТД. (Швейцария)

|
|
Претензии потребителей следует направлять |
X



